[English] 日本語
 Yorodumi
Yorodumi- PDB-5do9: Structure of regulator of G protein signaling 8 (RGS8) in complex... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 5do9 | ||||||
|---|---|---|---|---|---|---|---|
| Title | Structure of regulator of G protein signaling 8 (RGS8) in complex with AlF4-activated Galpha-q | ||||||
 Components Components |
| ||||||
 Keywords Keywords | PROTEIN BINDING / GTP-Binding Protein alpha subunits / Gq-G11 / RGS proteins | ||||||
| Function / homology |  Function and homology information Function and homology informationFatty Acids bound to GPR40 (FFAR1) regulate insulin secretion / PLC beta mediated events / Acetylcholine regulates insulin secretion / forebrain neuron development / regulation of melanocyte differentiation / Cooperation of PDCL (PhLP1) and TRiC/CCT in G-protein beta folding / Thromboxane signalling through TP receptor / Thrombin signalling through proteinase activated receptors (PARs) / G-protein activation / Turbulent (oscillatory, disturbed) flow shear stress activates signaling by PIEZO1 and integrins in endothelial cells ...Fatty Acids bound to GPR40 (FFAR1) regulate insulin secretion / PLC beta mediated events / Acetylcholine regulates insulin secretion / forebrain neuron development / regulation of melanocyte differentiation / Cooperation of PDCL (PhLP1) and TRiC/CCT in G-protein beta folding / Thromboxane signalling through TP receptor / Thrombin signalling through proteinase activated receptors (PARs) / G-protein activation / Turbulent (oscillatory, disturbed) flow shear stress activates signaling by PIEZO1 and integrins in endothelial cells / phospholipase C-activating G protein-coupled acetylcholine receptor signaling pathway / G alpha (q) signalling events / endothelin receptor signaling pathway / developmental pigmentation / phospholipase C-activating dopamine receptor signaling pathway / regulation of dopamine receptor signaling pathway / High laminar flow shear stress activates signaling by PIEZO1 and PECAM1:CDH5:KDR in endothelial cells / ADP signalling through P2Y purinoceptor 1 / regulation of platelet activation / cranial skeletal system development / maternal behavior / embryonic digit morphogenesis / glutamate receptor signaling pathway / neuronal cell body membrane / neuron remodeling / alkylglycerophosphoethanolamine phosphodiesterase activity / ligand-gated ion channel signaling pathway / action potential / positive regulation of GTPase activity / negative regulation of signal transduction / postsynaptic cytosol / enzyme regulator activity / GTPase activator activity / post-embryonic development / skeletal system development / positive regulation of insulin secretion / G protein-coupled receptor binding / regulation of blood pressure / cytoplasmic side of plasma membrane / G-protein beta/gamma-subunit complex binding / adenylate cyclase-activating G protein-coupled receptor signaling pathway / G protein-coupled acetylcholine receptor signaling pathway / heterotrimeric G-protein complex / heart development / cell body / G protein activity / nuclear membrane / G alpha (i) signalling events / phospholipase C-activating G protein-coupled receptor signaling pathway / Hydrolases; Acting on acid anhydrides; Acting on GTP to facilitate cellular and subcellular movement / perikaryon / G protein-coupled receptor signaling pathway / GTPase activity / dendrite / synapse / GTP binding / Golgi apparatus / metal ion binding / membrane / nucleus / plasma membrane Similarity search - Function | ||||||
| Biological species |   Homo sapiens (human) Homo sapiens (human) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / MOLECULAR REPLACEMENT /  molecular replacement / Resolution: 2.6 Å molecular replacement / Resolution: 2.6 Å | ||||||
 Authors Authors | Taylor, V.G. / Tesmer, J.J.G. | ||||||
 Citation Citation |  Journal: J.Biol.Chem. / Year: 2016 Journal: J.Biol.Chem. / Year: 2016Title: Structure of the Regulator of G Protein Signaling 8 (RGS8)-G alpha q Complex: MOLECULAR BASIS FOR G alpha SELECTIVITY. Authors: Taylor, V.G. / Bommarito, P.A. / Tesmer, J.J. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  5do9.cif.gz 5do9.cif.gz | 578.7 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb5do9.ent.gz pdb5do9.ent.gz | 477 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  5do9.json.gz 5do9.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/do/5do9 https://data.pdbj.org/pub/pdb/validation_reports/do/5do9 ftp://data.pdbj.org/pub/pdb/validation_reports/do/5do9 ftp://data.pdbj.org/pub/pdb/validation_reports/do/5do9 | HTTPS FTP |
|---|
-Related structure data
| Similar structure data |
|---|
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 | 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 | 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unit cell |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Noncrystallographic symmetry (NCS) | NCS domain:
NCS domain segments: Component-ID: _ / Refine code: _
NCS ensembles :
|
- Components
Components
-Protein , 2 types, 6 molecules ACEBDF
| #1: Protein | Mass: 36853.871 Da / Num. of mol.: 3 Fragment: Guanine nucleotide-binding protein G(q) subunit alpha Source method: isolated from a genetically manipulated source Source: (gene. exp.)   #2: Protein | Mass: 15760.928 Da / Num. of mol.: 3 / Fragment: RGS Domain Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: RGS8 / Plasmid: pQTEV / Production host: Homo sapiens (human) / Gene: RGS8 / Plasmid: pQTEV / Production host:  |
|---|
-Non-polymers , 4 types, 240 molecules 
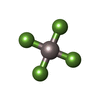


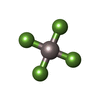


| #3: Chemical | | #4: Chemical | #5: Chemical | #6: Water | ChemComp-HOH / | |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.97 Å3/Da / Density % sol: 58.64 % |
|---|---|
| Crystal grow | Temperature: 277.15 K / Method: vapor diffusion, hanging drop / pH: 5.5 / Details: Ammonium acetate, BisTris pH 5.5, PEG 8000 |
-Data collection
| Diffraction | Mean temperature: 110 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  APS APS  / Beamline: 21-ID-D / Wavelength: 1.0383 Å / Beamline: 21-ID-D / Wavelength: 1.0383 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Detector | Type: MAR scanner 300 mm plate / Detector: IMAGE PLATE / Date: Jun 16, 2014 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radiation wavelength | Wavelength: 1.0383 Å / Relative weight: 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reflection | Resolution: 2.6→30 Å / Num. obs: 56869 / % possible obs: 99.8 % / Redundancy: 3.7 % / Rmerge(I) obs: 0.125 / Rpim(I) all: 0.075 / Rrim(I) all: 0.146 / Χ2: 1.764 / Net I/av σ(I): 14.233 / Net I/σ(I): 7.6 / Num. measured all: 211145 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reflection shell | Diffraction-ID: 1 / Rejects: _
|
-Phasing
| Phasing | Method:  molecular replacement molecular replacement | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Phasing MR | Model details: Phaser MODE: MR_AUTO
|
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT / Resolution: 2.6→30 Å / Cor.coef. Fo:Fc: 0.949 / Cor.coef. Fo:Fc free: 0.913 / WRfactor Rfree: 0.2066 / WRfactor Rwork: 0.1592 / FOM work R set: 0.827 / SU B: 23.884 / SU ML: 0.219 / SU R Cruickshank DPI: 0.5517 / SU Rfree: 0.2745 / Cross valid method: THROUGHOUT / σ(F): 0 / ESU R: 0.552 / ESU R Free: 0.275 / Stereochemistry target values: MAXIMUM LIKELIHOOD MOLECULAR REPLACEMENT / Resolution: 2.6→30 Å / Cor.coef. Fo:Fc: 0.949 / Cor.coef. Fo:Fc free: 0.913 / WRfactor Rfree: 0.2066 / WRfactor Rwork: 0.1592 / FOM work R set: 0.827 / SU B: 23.884 / SU ML: 0.219 / SU R Cruickshank DPI: 0.5517 / SU Rfree: 0.2745 / Cross valid method: THROUGHOUT / σ(F): 0 / ESU R: 0.552 / ESU R Free: 0.275 / Stereochemistry target values: MAXIMUM LIKELIHOODDetails: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS U VALUES : WITH TLS ADDED
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Ion probe radii: 0.8 Å / Shrinkage radii: 0.8 Å / VDW probe radii: 1.2 Å / Solvent model: MASK | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso max: 256.16 Å2 / Biso mean: 47.491 Å2 / Biso min: 18.62 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: final / Resolution: 2.6→30 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints NCS | Refine-ID: X-RAY DIFFRACTION / Type: interatomic distance / Weight position: 0.05
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Resolution: 2.597→2.664 Å / Total num. of bins used: 20
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller











 PDBj
PDBj














