[English] 日本語
 Yorodumi
Yorodumi- PDB-4r7m: Structure of the m17 leucyl aminopeptidase from malaria complexed... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 4r7m | ||||||
|---|---|---|---|---|---|---|---|
| Title | Structure of the m17 leucyl aminopeptidase from malaria complexed with a hydroxamic acid-based inhibitor | ||||||
 Components Components | M17 leucyl aminopeptidase | ||||||
 Keywords Keywords | HYDROLASE/HYDROLASE INHIBITOR / PROTEASE / HYDROLASE-HYDROLASE INHIBITOR complex | ||||||
| Function / homology |  Function and homology information Function and homology informationHydrolases; Acting on peptide bonds (peptidases); Dipeptidases / leucyl aminopeptidase / metallodipeptidase activity / peptide catabolic process / metalloaminopeptidase activity / carboxypeptidase activity / peptidase activity / manganese ion binding / proteolysis / zinc ion binding ...Hydrolases; Acting on peptide bonds (peptidases); Dipeptidases / leucyl aminopeptidase / metallodipeptidase activity / peptide catabolic process / metalloaminopeptidase activity / carboxypeptidase activity / peptidase activity / manganese ion binding / proteolysis / zinc ion binding / metal ion binding / identical protein binding / cytosol / cytoplasm Similarity search - Function | ||||||
| Biological species |  | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2.85 Å MOLECULAR REPLACEMENT / Resolution: 2.85 Å | ||||||
 Authors Authors | Drinkwater, N. / Mcgowan, S. | ||||||
 Citation Citation |  Journal: J.Med.Chem. / Year: 2014 Journal: J.Med.Chem. / Year: 2014Title: Two-Pronged Attack: Dual Inhibition of Plasmodium falciparum M1 and M17 Metalloaminopeptidases by a Novel Series of Hydroxamic Acid-Based Inhibitors. Authors: Mistry, S.N. / Drinkwater, N. / Ruggeri, C. / Sivaraman, K.K. / Loganathan, S. / Fletcher, S. / Drag, M. / Paiardini, A. / Avery, V.M. / Scammells, P.J. / McGowan, S. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  4r7m.cif.gz 4r7m.cif.gz | 2.2 MB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb4r7m.ent.gz pdb4r7m.ent.gz | 1.8 MB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  4r7m.json.gz 4r7m.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/r7/4r7m https://data.pdbj.org/pub/pdb/validation_reports/r7/4r7m ftp://data.pdbj.org/pub/pdb/validation_reports/r7/4r7m ftp://data.pdbj.org/pub/pdb/validation_reports/r7/4r7m | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  4r5tC  4r5vC  4r5xC  4r6tC  4r76C  3kqzS C: citing same article ( S: Starting model for refinement |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| Unit cell |
| ||||||||
| Details | the biological unit is a hexamer, there are 2 biological units in the asymmetric unit |
- Components
Components
-Protein , 1 types, 12 molecules ABCDEFGHIJKL
| #1: Protein | Mass: 58708.973 Da / Num. of mol.: 12 / Fragment: unp residues 84-605 / Mutation: D152N, D515N, D516N Source method: isolated from a genetically manipulated source Source: (gene. exp.)   |
|---|
-Non-polymers , 7 types, 286 molecules 

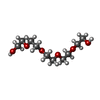










| #2: Chemical | ChemComp-ZN / #3: Chemical | ChemComp-CO3 / #4: Chemical | ChemComp-1PE / #5: Chemical | ChemComp-3MW / #6: Chemical | ChemComp-SO4 / #7: Chemical | ChemComp-DMS / | #8: Water | ChemComp-HOH / | |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.42 Å3/Da / Density % sol: 49.27 % |
|---|---|
| Crystal grow | Temperature: 298 K / Method: vapor diffusion, hanging drop / pH: 8.5 Details: 40% (v/v) PEG 400, 0.1 M Tris pH 8.5, 0.2 M Li2SO4, 1 mM TCEP, vapor diffusion, hanging drop, temperature 298K |
-Data collection
| Diffraction | Mean temperature: 100 K | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  Australian Synchrotron Australian Synchrotron  / Beamline: MX2 / Wavelength: 0.9537 Å / Beamline: MX2 / Wavelength: 0.9537 Å | ||||||||||||||||||
| Detector | Type: ADSC QUANTUM 315r / Detector: CCD / Date: Mar 6, 2014 | ||||||||||||||||||
| Radiation | Monochromator: DOUBLE CRYSTAL SILICON 111 / Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray | ||||||||||||||||||
| Radiation wavelength | Wavelength: 0.9537 Å / Relative weight: 1 | ||||||||||||||||||
| Reflection | Resolution: 2.85→36.01 Å / Num. obs: 144105 / % possible obs: 91.2 % / Redundancy: 2.4 % / Biso Wilson estimate: 23.14 Å2 / Rmerge(I) obs: 0.229 / Net I/σ(I): 3.4 | ||||||||||||||||||
| Reflection shell |
|
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: 3KQZ Resolution: 2.85→36.01 Å / SU ML: 0.42 / σ(F): 1.34 / Phase error: 31.85 / Stereochemistry target values: ML
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Shrinkage radii: 0.9 Å / VDW probe radii: 1.11 Å / Solvent model: FLAT BULK SOLVENT MODEL | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 29.71 Å2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 2.85→36.01 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Origin x: 88.7015 Å / Origin y: 55.7103 Å / Origin z: 78.3365 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group | Selection details: all |
 Movie
Movie Controller
Controller























 PDBj
PDBj