+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 3msf | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Crystal structure of Thermolysin in complex with Urea | ||||||
 要素 要素 | Thermolysin | ||||||
 キーワード キーワード | HYDROLASE / PROTEASE / Fragment soaking / METALLOPROTEASE / Metal-binding / Secreted / Zymogen / Urea / Fragment based lead discovery | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報thermolysin / metalloendopeptidase activity / proteolysis / extracellular region / metal ion binding 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 |  X線回折 / X線回折 /  フーリエ合成 / 解像度: 2.09 Å フーリエ合成 / 解像度: 2.09 Å | ||||||
 データ登録者 データ登録者 | Behnen, J. / Heine, A. / Klebe, G. | ||||||
 引用 引用 |  ジャーナル: Chemmedchem / 年: 2012 ジャーナル: Chemmedchem / 年: 2012タイトル: Experimental and computational active site mapping as a starting point to fragment-based lead discovery. 著者: Behnen, J. / Koster, H. / Neudert, G. / Craan, T. / Heine, A. / Klebe, G. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  3msf.cif.gz 3msf.cif.gz | 81 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb3msf.ent.gz pdb3msf.ent.gz | 58.6 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  3msf.json.gz 3msf.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  3msf_validation.pdf.gz 3msf_validation.pdf.gz | 450.2 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  3msf_full_validation.pdf.gz 3msf_full_validation.pdf.gz | 453.7 KB | 表示 | |
| XML形式データ |  3msf_validation.xml.gz 3msf_validation.xml.gz | 15.6 KB | 表示 | |
| CIF形式データ |  3msf_validation.cif.gz 3msf_validation.cif.gz | 22 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ms/3msf https://data.pdbj.org/pub/pdb/validation_reports/ms/3msf ftp://data.pdbj.org/pub/pdb/validation_reports/ms/3msf ftp://data.pdbj.org/pub/pdb/validation_reports/ms/3msf | HTTPS FTP |
-関連構造データ
| 関連構造データ |  3ms3C  3msaC  3msnC  3n21C  3n4aC  3n9wC  3nn7C  3nx8C  3pczC  3prsC  3pvkC  3pwwC  2a7gS C: 同じ文献を引用 ( S: 精密化の開始モデル |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
| ||||||||
| Components on special symmetry positions |
|
- 要素
要素
-タンパク質 , 1種, 1分子 A
| #1: タンパク質 | 分子量: 34360.336 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  参照: UniProt: P00800, thermolysin |
|---|
-非ポリマー , 5種, 172分子 

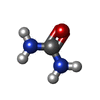






| #2: 化合物 | ChemComp-ZN / | ||||||
|---|---|---|---|---|---|---|---|
| #3: 化合物 | ChemComp-CA / #4: 化合物 | ChemComp-URE / | #5: 化合物 | #6: 水 | ChemComp-HOH / | |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.32 Å3/Da / 溶媒含有率: 46.95 % |
|---|---|
| 結晶化 | 温度: 288 K / 手法: 蒸気拡散法, シッティングドロップ法 / pH: 7.5 詳細: 50 mM Tris/HCl, 50 % DMSO, 1.8 M CsCl, pH 7.5, VAPOR DIFFUSION, SITTING DROP, temperature 288K |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU RUH3R / 波長: 1.5418 Å 回転陽極 / タイプ: RIGAKU RUH3R / 波長: 1.5418 Å |
| 検出器 | タイプ: RIGAKU RAXIS IV / 検出器: IMAGE PLATE / 日付: 2008年5月16日 / 詳細: mirrors |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.5418 Å / 相対比: 1 |
| 反射 | 解像度: 2.09→25 Å / Num. all: 19899 / Num. obs: 19899 / % possible obs: 99.7 % / Observed criterion σ(F): 0 / Observed criterion σ(I): 0 / 冗長度: 6.8 % / Rsym value: 0.134 / Net I/σ(I): 16.5 |
| 反射 シェル | 解像度: 2.09→2.13 Å / 冗長度: 6.6 % / Mean I/σ(I) obs: 4.7 / Num. unique all: 967 / Rsym value: 0.476 / % possible all: 99.9 |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  フーリエ合成 フーリエ合成開始モデル: PDB entry 2A7G 解像度: 2.09→10 Å / Num. parameters: 10446 / Num. restraintsaints: 10143 / 交差検証法: FREE R / σ(F): 0 / 立体化学のターゲット値: ENGH AND HUBER
| |||||||||||||||||||||||||||||||||
| Refine analyze | Num. disordered residues: 0 / Occupancy sum hydrogen: 2238 / Occupancy sum non hydrogen: 2594.02 | |||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.09→10 Å
| |||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 2.09→2.13 Å / Num. reflection obs: 18714 |
 ムービー
ムービー コントローラー
コントローラー























 PDBj
PDBj



