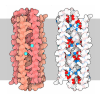
| 登録情報 | データベース: PDB / ID: 3loe
|
|---|
| タイトル | Crystal structure of human alpha-defensin 1 (F28A mutant) |
|---|
 要素 要素 | Neutrophil defensin 1 |
|---|
 キーワード キーワード | ANTIMICROBIAL PROTEIN / ANTIMICROBIAL PEPTIDE / HUMAN ALPHA DEFENSIN 1 / HUMAN NEUTROPHIL PEPTIDE 1 / HNP1 / ANTIBIOTIC / ANTIMICROBIAL / Antiviral defense / Defensin / Disulfide bond / Fungicide / Phosphoprotein / Secreted |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
pore-forming activity / disruption of plasma membrane integrity in another organism / Defensins / killing by host of symbiont cells / T cell chemotaxis / Alpha-defensins / defense response to protozoan / defense response to fungus / estrogen receptor signaling pathway / innate immune response in mucosa ...pore-forming activity / disruption of plasma membrane integrity in another organism / Defensins / killing by host of symbiont cells / T cell chemotaxis / Alpha-defensins / defense response to protozoan / defense response to fungus / estrogen receptor signaling pathway / innate immune response in mucosa / Golgi lumen / chemotaxis / antimicrobial humoral immune response mediated by antimicrobial peptide / azurophil granule lumen / antibacterial humoral response / : / cellular response to lipopolysaccharide / defense response to Gram-negative bacterium / defense response to virus / killing of cells of another organism / defense response to Gram-positive bacterium / immune response / Neutrophil degranulation / extracellular space / extracellular exosome / extracellular region類似検索 - 分子機能 Mammalian defensins signature. / Alpha-defensin, C-terminal / Mammalian defensin / Alpha-defensin propeptide / Alpha-defensin / Defensin propeptide / Defensin propeptide / Beta/alpha-defensin, C-terminal / Defensin/corticostatin family類似検索 - ドメイン・相同性 |
|---|
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 1.56 Å 分子置換 / 解像度: 1.56 Å |
|---|
 データ登録者 データ登録者 | Pazgier, M. / Lu, W. |
|---|
 引用 引用 |  ジャーナル: J.Biol.Chem. / 年: 2010 ジャーナル: J.Biol.Chem. / 年: 2010
タイトル: Trp-26 imparts functional versatility to human alpha-defensin HNP1.
著者: Wei, G. / Pazgier, M. / de Leeuw, E. / Rajabi, M. / Li, J. / Zou, G. / Jung, G. / Yuan, W. / Lu, W.Y. / Lehrer, R.I. / Lu, W. |
|---|
| 履歴 | | 登録 | 2010年2月3日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2010年3月9日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2011年7月13日 | Group: Advisory / Refinement description / Version format compliance |
|---|
| 改定 1.2 | 2021年10月13日 | Group: Database references / Derived calculations / カテゴリ: database_2 / struct_ref_seq_dif / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
| 改定 1.3 | 2023年9月6日 | Group: Data collection / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond / pdbx_initial_refinement_model |
|---|
| 改定 1.4 | 2024年11月27日 | Group: Structure summary
カテゴリ: pdbx_entry_details / pdbx_modification_feature |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 X線回折 /
X線回折 /  分子置換 / 解像度: 1.56 Å
分子置換 / 解像度: 1.56 Å  データ登録者
データ登録者 引用
引用 ジャーナル: J.Biol.Chem. / 年: 2010
ジャーナル: J.Biol.Chem. / 年: 2010 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 3loe.cif.gz
3loe.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb3loe.ent.gz
pdb3loe.ent.gz PDB形式
PDB形式 3loe.json.gz
3loe.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 3loe_validation.pdf.gz
3loe_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 3loe_full_validation.pdf.gz
3loe_full_validation.pdf.gz 3loe_validation.xml.gz
3loe_validation.xml.gz 3loe_validation.cif.gz
3loe_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/lo/3loe
https://data.pdbj.org/pub/pdb/validation_reports/lo/3loe ftp://data.pdbj.org/pub/pdb/validation_reports/lo/3loe
ftp://data.pdbj.org/pub/pdb/validation_reports/lo/3loe リンク
リンク 集合体
集合体

 要素
要素 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 回転陽極 / タイプ: RIGAKU MICROMAX-007 / 波長: 1.54 Å
回転陽極 / タイプ: RIGAKU MICROMAX-007 / 波長: 1.54 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー



















 PDBj
PDBj