+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 2tpi | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | ON THE DISORDERED ACTIVATION DOMAIN IN TRYPSINOGEN. CHEMICAL LABELLING AND LOW-TEMPERATURE CRYSTALLOGRAPHY | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | Hydrolase/hydrolase INHIBITOR / COMPLEX (PROTEINASE-INHIBITOR) / Hydrolase-hydrolase INHIBITOR COMPLEX | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報trypsinogen activation / negative regulation of serine-type endopeptidase activity / sulfate binding / potassium channel inhibitor activity / negative regulation of platelet aggregation / zymogen binding / molecular function inhibitor activity / negative regulation of thrombin-activated receptor signaling pathway / trypsin / serpin family protein binding ...trypsinogen activation / negative regulation of serine-type endopeptidase activity / sulfate binding / potassium channel inhibitor activity / negative regulation of platelet aggregation / zymogen binding / molecular function inhibitor activity / negative regulation of thrombin-activated receptor signaling pathway / trypsin / serpin family protein binding / serine protease inhibitor complex / digestion / serine-type endopeptidase inhibitor activity / protease binding / endopeptidase activity / serine-type endopeptidase activity / calcium ion binding / proteolysis / extracellular space / metal ion binding 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 |  X線回折 / 解像度: 2.1 Å X線回折 / 解像度: 2.1 Å | ||||||
 データ登録者 データ登録者 | Walter, J. / Steigemann, W. / Singh, T.P. / Bartunik, H. / Bode, W. / Huber, R. | ||||||
 引用 引用 | ジャーナル: Acta Crystallogr.,Sect.B / 年: 1982 タイトル: On the Disordered Activation Domain in Trypsinogen. Chemical Labelling and Low-Temperature Crystallography 著者: Walter, J. / Steigemann, W. / Singh, T.P. / Bartunik, H. / Bode, W. / Huber, R. #1:  ジャーナル: J.Mol.Biol. / 年: 1979 ジャーナル: J.Mol.Biol. / 年: 1979タイトル: The Transition of Bovine Trypsinogen to a Trypsin-Like State Upon Strong Ligand Binding. II. The Binding of the Pancreatic Trypsin Inhibitor and of Isoleucine-Valine and of Sequentially ...タイトル: The Transition of Bovine Trypsinogen to a Trypsin-Like State Upon Strong Ligand Binding. II. The Binding of the Pancreatic Trypsin Inhibitor and of Isoleucine-Valine and of Sequentially Related Peptides to Trypsinogen and to P-Guanidinobenzoate-Trypsinogen 著者: Bode, W. #2:  ジャーナル: J.Mol.Biol. / 年: 1978 ジャーナル: J.Mol.Biol. / 年: 1978タイトル: The Transition of Bovine Trypsinogen to a Trypsin-Like State Upon Strong Ligand Binding. The Refined Crystal Structures of the Bovine Trypsinogen-Pancreatic Trypsin Inhibitor Complex ...タイトル: The Transition of Bovine Trypsinogen to a Trypsin-Like State Upon Strong Ligand Binding. The Refined Crystal Structures of the Bovine Trypsinogen-Pancreatic Trypsin Inhibitor Complex and of its Ternary Complex with Ile-Val at 1.9 Angstroms Resolution 著者: Bode, W. / Schwager, P. / Huber, R. #3:  ジャーナル: Acc.Chem.Res. / 年: 1978 ジャーナル: Acc.Chem.Res. / 年: 1978タイトル: Structural Basis of the Activation and Action of Trypsin 著者: Huber, R. / Bode, W. #4:  ジャーナル: Biophys.Struct.Mech. / 年: 1975 ジャーナル: Biophys.Struct.Mech. / 年: 1975タイトル: The Structure of the Complex Formed by Bovine Trypsin and Bovine Pancreatic Trypsin Inhibitor. III. Structure of the Anhydro-Trypsin-Inhibitor Complex 著者: Huber, R. / Bode, W. / Kukla, D. / Kohl, W. / Ryan, C.A. #5:  ジャーナル: J.Mol.Biol. / 年: 1974 ジャーナル: J.Mol.Biol. / 年: 1974タイトル: Structure of the Complex Formed by Bovine Trypsin and Bovine Pancreatic Trypsin Inhibitor. II. Crystallographic Refinement at 1.9 Angstroms Resolution 著者: Huber, R. / Kukla, D. / Bode, W. / Schwager, P. / Bartels, K. / Deisenhofer, J. / Steigemann, W. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  2tpi.cif.gz 2tpi.cif.gz | 66.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb2tpi.ent.gz pdb2tpi.ent.gz | 48.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  2tpi.json.gz 2tpi.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  2tpi_validation.pdf.gz 2tpi_validation.pdf.gz | 460 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  2tpi_full_validation.pdf.gz 2tpi_full_validation.pdf.gz | 464.6 KB | 表示 | |
| XML形式データ |  2tpi_validation.xml.gz 2tpi_validation.xml.gz | 14.6 KB | 表示 | |
| CIF形式データ |  2tpi_validation.cif.gz 2tpi_validation.cif.gz | 20.3 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/tp/2tpi https://data.pdbj.org/pub/pdb/validation_reports/tp/2tpi ftp://data.pdbj.org/pub/pdb/validation_reports/tp/2tpi ftp://data.pdbj.org/pub/pdb/validation_reports/tp/2tpi | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
| ||||||||
| Atom site foot note | 1: SEE REMARK 4. 2: IN THE DISULFIDE CYS 191 - CYS 220 A MERCURY ATOM IS COVALENTLY BOUND BETWEEN THE TWO SULFUR ATOMS. IT ADOPTS SEVERAL POSITIONS AS DO THE ADJACENT ATOMS. A SPECIAL MERCURY-CYSTINE GROUP WAS ...2: IN THE DISULFIDE CYS 191 - CYS 220 A MERCURY ATOM IS COVALENTLY BOUND BETWEEN THE TWO SULFUR ATOMS. IT ADOPTS SEVERAL POSITIONS AS DO THE ADJACENT ATOMS. A SPECIAL MERCURY-CYSTINE GROUP WAS CONSTRUCTED WHICH HAD THREE INDEPENDENT POSITIONS FOR THE CB, SG AND HG ATOMS. |
- 要素
要素
-タンパク質 , 2種, 2分子 ZI
| #1: タンパク質 | 分子量: 24012.953 Da / 分子数: 1 / 由来タイプ: 組換発現 / 参照: UniProt: P00760, trypsin |
|---|---|
| #2: タンパク質 | 分子量: 6527.568 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
-非ポリマー , 4種, 142分子 
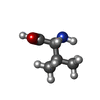





| #3: 化合物 | ChemComp-ILE / |
|---|---|
| #4: 化合物 | ChemComp-VAL / |
| #5: 化合物 | ChemComp-HG / |
| #6: 水 | ChemComp-HOH / |
-詳細
| 構成要素の詳細 | THE RESIDUES 1016 AND 1017 REPRESENT A DIPEPTIDE (ILE-VAL) BOUND TO THE ENZYME THE N-TERMINUS OF ...THE RESIDUES 1016 AND 1017 REPRESENT A DIPEPTIDE (ILE-VAL) BOUND TO THE ENZYME THE N-TERMINUS OF THE ZYMOGEN COMPONENT IS ORDERED ONLY FROM GLY 19 ONWARDS. THIS ENTRY CONTAINS NO COORDINATE |
|---|---|
| Has protein modification | Y |
| 非ポリマーの詳細 | IN THE DISULFIDE CYS 191 - CYS 220 A MERCURY ATOM IS COVALENTLY BOUND BETWEEN THE TWO SULFUR ATOMS. ...IN THE DISULFIDE CYS 191 - CYS 220 A MERCURY ATOM IS COVALENTLY |
| 配列の詳細 | THE 229 AMINO ACIDS OF TRYPSINOGEN ARE IDENTIFIED BY THE RESIDUE NUMBERS OF THE HOMOLOGOUS ...THE 229 AMINO ACIDS OF TRYPSINOGE |
-実験情報
-実験
| 実験 | 手法:  X線回折 X線回折 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 3.18 Å3/Da / 溶媒含有率: 61.26 % | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | *PLUS pH: 7 / 手法: 蒸気拡散法 | ||||||||||||||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 放射 | 散乱光タイプ: x-ray |
|---|---|
| 放射波長 | 相対比: 1 |
- 解析
解析
| 精密化 | 解像度: 2.1→6.5 Å / Rfactor Rwork: 0.2 詳細: IN THE DISULFIDE CYS 191 - CYS 220 A MERCURY ATOM IS COVALENTLY BOUND BETWEEN THE TWO SULFUR ATOMS. IT ADOPTS SEVERAL POSITIONS AS DO THE ADJACENT ATOMS. A SPECIAL MERCURY-CYSTINE GROUP WAS ...詳細: IN THE DISULFIDE CYS 191 - CYS 220 A MERCURY ATOM IS COVALENTLY BOUND BETWEEN THE TWO SULFUR ATOMS. IT ADOPTS SEVERAL POSITIONS AS DO THE ADJACENT ATOMS. A SPECIAL MERCURY-CYSTINE GROUP WAS CONSTRUCTED WHICH HAD THREE INDEPENDENT POSITIONS FOR THE CB, SG AND HG ATOMS. | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化ステップ | サイクル: LAST / 解像度: 2.1→6.5 Å
| ||||||||||||
| 精密化 | *PLUS Num. reflection obs: 14327 / 最高解像度: 2.1 Å / 最低解像度: 6.5 Å / Rfactor obs: 0.2 | ||||||||||||
| 溶媒の処理 | *PLUS | ||||||||||||
| 原子変位パラメータ | *PLUS Biso mean: 21 Å2 |
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj






















