| 登録情報 | データベース: PDB / ID: 2p4e
|
|---|
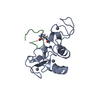
| タイトル | Crystal Structure of PCSK9 |
|---|
 要素 要素 | Proprotein convertase subtilisin/kexin type 9 |
|---|
 キーワード キーワード | HYDROLASE / protease / subtilisin / LDL receptor / LDL / endocytosis |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
low-density lipoprotein particle receptor catabolic process / negative regulation of receptor-mediated endocytosis involved in cholesterol transport / extrinsic component of external side of plasma membrane / negative regulation of sodium ion import across plasma membrane / PCSK9-LDLR complex / PCSK9-AnxA2 complex / negative regulation of receptor recycling / apolipoprotein receptor binding / very-low-density lipoprotein particle binding / low-density lipoprotein particle binding ...low-density lipoprotein particle receptor catabolic process / negative regulation of receptor-mediated endocytosis involved in cholesterol transport / extrinsic component of external side of plasma membrane / negative regulation of sodium ion import across plasma membrane / PCSK9-LDLR complex / PCSK9-AnxA2 complex / negative regulation of receptor recycling / apolipoprotein receptor binding / very-low-density lipoprotein particle binding / low-density lipoprotein particle binding / positive regulation of low-density lipoprotein particle receptor catabolic process / LDL clearance / lipoprotein metabolic process / very-low-density lipoprotein particle receptor binding / negative regulation of receptor internalization / COPII-coated ER to Golgi transport vesicle / endolysosome membrane / sodium channel inhibitor activity / negative regulation of low-density lipoprotein particle clearance / signaling receptor inhibitor activity / lysosomal transport / triglyceride metabolic process / low-density lipoprotein particle receptor binding / protein autoprocessing / regulation of neuron apoptotic process / positive regulation of receptor internalization / apolipoprotein binding / 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; セリンエンドペプチターゼ / cholesterol metabolic process / VLDLR internalisation and degradation / phospholipid metabolic process / neurogenesis / cholesterol homeostasis / cellular response to starvation / Post-translational protein phosphorylation / kidney development / liver development / cellular response to insulin stimulus / neuron differentiation / Regulation of Insulin-like Growth Factor (IGF) transport and uptake by Insulin-like Growth Factor Binding Proteins (IGFBPs) / late endosome / positive regulation of neuron apoptotic process / early endosome / lysosome / endoplasmic reticulum lumen / lysosomal membrane / serine-type endopeptidase activity / apoptotic process / perinuclear region of cytoplasm / cell surface / endoplasmic reticulum / Golgi apparatus / extracellular space / RNA binding / extracellular region / plasma membrane / cytoplasm類似検索 - 分子機能 Proprotein convertase subtilisin/kexin type 9 / Peptidase S8 propeptide/proteinase inhibitor I9 / Proprotein convertase subtilisin/kexin type 9, C-terminal domain 3 / Proprotein convertase subtilisin/kexin type 9, C-terminal domain 2 / Proprotein convertase subtilisin/kexin type 9, C-terminal domain 1 / Proprotein convertase subtilisin-like/kexin type 9 C-terminal domain / Proprotein convertase subtilisin-like/kexin type 9 C-terminal domain / Proprotein convertase subtilisin-like/kexin type 9 C-terminal domain / Proteinase K-like catalytic domain / Peptidase S8 propeptide/proteinase inhibitor I9 ...Proprotein convertase subtilisin/kexin type 9 / Peptidase S8 propeptide/proteinase inhibitor I9 / Proprotein convertase subtilisin/kexin type 9, C-terminal domain 3 / Proprotein convertase subtilisin/kexin type 9, C-terminal domain 2 / Proprotein convertase subtilisin/kexin type 9, C-terminal domain 1 / Proprotein convertase subtilisin-like/kexin type 9 C-terminal domain / Proprotein convertase subtilisin-like/kexin type 9 C-terminal domain / Proprotein convertase subtilisin-like/kexin type 9 C-terminal domain / Proteinase K-like catalytic domain / Peptidase S8 propeptide/proteinase inhibitor I9 / Peptidase inhibitor I9 / Peptidase S8 propeptide/proteinase inhibitor I9 superfamily / : / Peptidase S8, subtilisin-related / Serine proteases, subtilase domain profile. / Peptidase S8/S53 domain superfamily / Peptidase S8/S53 domain / Peptidase S8/S53 domain / Subtilase family / Alpha-Beta Plaits / Jelly Rolls / Sandwich / Rossmann fold / 2-Layer Sandwich / 3-Layer(aba) Sandwich / Mainly Beta / Alpha Beta類似検索 - ドメイン・相同性 : / Proprotein convertase subtilisin/kexin type 9類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.98 Å 分子置換 / 解像度: 1.98 Å |
|---|
 データ登録者 データ登録者 | Cunningham, D. / Danley, D.E. / Geoghegan, F.K. / Griffor, M.C. / Hawkins, J.L. / Qiu, X. |
|---|
 引用 引用 |  ジャーナル: Nat.Struct.Mol.Biol. / 年: 2007 ジャーナル: Nat.Struct.Mol.Biol. / 年: 2007
タイトル: Structural and biophysical studies of PCSK9 and its mutants linked to familial hypercholesterolemia.
著者: Cunningham, D. / Danley, D.E. / Geoghegan, K.F. / Griffor, M.C. / Hawkins, J.L. / Subashi, T.A. / Varghese, A.H. / Ammirati, M.J. / Culp, J.S. / Hoth, L.R. / Mansour, M.N. / McGrath, K.M. / ...著者: Cunningham, D. / Danley, D.E. / Geoghegan, K.F. / Griffor, M.C. / Hawkins, J.L. / Subashi, T.A. / Varghese, A.H. / Ammirati, M.J. / Culp, J.S. / Hoth, L.R. / Mansour, M.N. / McGrath, K.M. / Seddon, A.P. / Shenolikar, S. / Stutzman-Engwall, K.J. / Warren, L.C. / Xia, D. / Qiu, X. |
|---|
| 履歴 | | 登録 | 2007年3月12日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2007年4月10日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2008年5月1日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2011年7月13日 | Group: Derived calculations / Version format compliance |
|---|
| 改定 1.3 | 2023年8月30日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model / pdbx_struct_conn_angle / struct_conn / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_struct_conn_angle.ptnr1_auth_asym_id / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_atom_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr3_auth_asym_id / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_asym_id / _pdbx_struct_conn_angle.ptnr3_label_atom_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _pdbx_struct_conn_angle.value / _struct_conn.pdbx_dist_value / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_asym_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
| 改定 1.4 | 2024年10月30日 | Group: Structure summary
カテゴリ: pdbx_entry_details / pdbx_modification_feature |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.98 Å
分子置換 / 解像度: 1.98 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Nat.Struct.Mol.Biol. / 年: 2007
ジャーナル: Nat.Struct.Mol.Biol. / 年: 2007 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 2p4e.cif.gz
2p4e.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb2p4e.ent.gz
pdb2p4e.ent.gz PDB形式
PDB形式 2p4e.json.gz
2p4e.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 2p4e_validation.pdf.gz
2p4e_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 2p4e_full_validation.pdf.gz
2p4e_full_validation.pdf.gz 2p4e_validation.xml.gz
2p4e_validation.xml.gz 2p4e_validation.cif.gz
2p4e_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/p4/2p4e
https://data.pdbj.org/pub/pdb/validation_reports/p4/2p4e ftp://data.pdbj.org/pub/pdb/validation_reports/p4/2p4e
ftp://data.pdbj.org/pub/pdb/validation_reports/p4/2p4e
 リンク
リンク 集合体
集合体


 要素
要素 Homo sapiens (ヒト) / 遺伝子: PCSK9, NARC1 / プラスミド: PCSK9
Homo sapiens (ヒト) / 遺伝子: PCSK9, NARC1 / プラスミド: PCSK9
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  APS
APS  / ビームライン: 17-ID / 波長: 1 Å
/ ビームライン: 17-ID / 波長: 1 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj



















