登録情報 データベース : PDB / ID : 2n42タイトル EC-NMR Structure of Human H-RasT35S mutant protein Determined by Combining Evolutionary Couplings (EC) and Sparse NMR Data GTPase HRas キーワード / / / / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / データ登録者 Tang, Y. / Huang, Y.J. / Hopf, T.A. / Sander, C. / Marks, D. / Montelione, G.T. / Northeast Structural Genomics Consortium (NESG) ジャーナル : J.Biol.Chem. / 年 : 2011タイトル : Solution structure of the state 1 conformer of GTP-bound H-Ras protein and distinct dynamic properties between the state 1 and state 2 conformers.著者 : Araki, M. / Shima, F. / Yoshikawa, Y. / Muraoka, S. / Ijiri, Y. / Nagahara, Y. / Shirono, T. / Kataoka, T. / Tamura, A. 履歴 登録 2015年6月16日 登録サイト / 処理サイト 改定 1.0 2015年7月1日 Provider / タイプ 改定 1.1 2015年7月22日 Group 改定 1.2 2015年8月12日 Group 改定 1.3 2023年6月14日 Group / Database references / Otherカテゴリ database_2 / pdbx_database_status ... database_2 / pdbx_database_status / pdbx_nmr_software / struct_ref_seq_dif Item _database_2.pdbx_DOI / _database_2.pdbx_database_accession ... _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_database_status.status_code_nmr_data / _pdbx_nmr_software.name / _struct_ref_seq_dif.details 改定 1.4 2024年5月15日 Group / Database references / カテゴリ / chem_comp_bond / database_2 / Item
すべて表示 表示を減らす Remark 0 THIS ENTRY 2N42 REFLECTS AN ALTERNATIVE MODELING OF THE ORIGINAL STRUCTURAL DATA IN 2LCF DETERMINED ... THIS ENTRY 2N42 REFLECTS AN ALTERNATIVE MODELING OF THE ORIGINAL STRUCTURAL DATA IN 2LCF DETERMINED BY AUTHORS: M.ARAKI,F.SHIMA,Y.YOSHIKAWA,S.MURAOKA,Y.IJIRI,Y.NAGAHARA,T.SHIRONO,T.KATAOKA,A.TAMURA
 データを開く
データを開く 基本情報
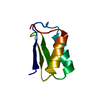
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) データ登録者
データ登録者 引用
引用 ジャーナル: J.Biol.Chem. / 年: 2011
ジャーナル: J.Biol.Chem. / 年: 2011 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 2n42.cif.gz
2n42.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb2n42.ent.gz
pdb2n42.ent.gz PDB形式
PDB形式 2n42.json.gz
2n42.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 2n42_validation.pdf.gz
2n42_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 2n42_full_validation.pdf.gz
2n42_full_validation.pdf.gz 2n42_validation.xml.gz
2n42_validation.xml.gz 2n42_validation.cif.gz
2n42_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/n4/2n42
https://data.pdbj.org/pub/pdb/validation_reports/n4/2n42 ftp://data.pdbj.org/pub/pdb/validation_reports/n4/2n42
ftp://data.pdbj.org/pub/pdb/validation_reports/n4/2n42 リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 遺伝子: HRAS, HRAS1 / プラスミド: pGEX-6P / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: HRAS, HRAS1 / プラスミド: pGEX-6P / 発現宿主: 
 試料調製
試料調製 解析
解析 ムービー
ムービー コントローラー
コントローラー
























 PDBj
PDBj

















 CYANA
CYANA