| 登録情報 | データベース: PDB / ID: 2ltz
|
|---|
| タイトル | Smurf2 WW3 domain in complex with a Smad7 derived peptide |
|---|
 要素 要素 | - E3 ubiquitin-protein ligase SMURF2
- Smad7 derived peptide
|
|---|
 キーワード キーワード | PROTEIN BINDING/PEPTIDE / WW / SMURF2 / SMAD7 / PROTEIN BINDING-PEPTIDE complex |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
positive regulation of chondrocyte hypertrophy / beta-catenin destruction complex disassembly / negative regulation of T-helper 17 type immune response / negative regulation of chondrocyte proliferation / negative regulation of T cell cytokine production / response to laminar fluid shear stress / regulation of ventricular cardiac muscle cell membrane depolarization / positive regulation of cell-cell adhesion mediated by cadherin / heteromeric SMAD protein complex / negative regulation of T-helper 17 cell differentiation ...positive regulation of chondrocyte hypertrophy / beta-catenin destruction complex disassembly / negative regulation of T-helper 17 type immune response / negative regulation of chondrocyte proliferation / negative regulation of T cell cytokine production / response to laminar fluid shear stress / regulation of ventricular cardiac muscle cell membrane depolarization / positive regulation of cell-cell adhesion mediated by cadherin / heteromeric SMAD protein complex / negative regulation of T-helper 17 cell differentiation / regulation of transforming growth factor beta receptor signaling pathway / positive regulation of trophoblast cell migration / activin receptor binding / protein-containing complex disassembly / regulation of epithelial to mesenchymal transition / negative regulation of transcription by competitive promoter binding / SMAD protein signal transduction / Signaling by BMP / type I transforming growth factor beta receptor binding / negative regulation of activin receptor signaling pathway / protein-containing complex localization / HECT-type E3 ubiquitin transferase / I-SMAD binding / adherens junction assembly / negative regulation of ossification / Wnt signaling pathway, planar cell polarity pathway / ureteric bud development / artery morphogenesis / negative regulation of epithelial to mesenchymal transition / ventricular cardiac muscle tissue morphogenesis / ventricular septum morphogenesis / negative regulation of SMAD protein signal transduction / SMAD binding / negative regulation of BMP signaling pathway / anatomical structure morphogenesis / regulation of cardiac muscle contraction / ubiquitin ligase complex / ubiquitin-like ligase-substrate adaptor activity / transcription regulator inhibitor activity / collagen binding / Downregulation of TGF-beta receptor signaling / Asymmetric localization of PCP proteins / transforming growth factor beta receptor signaling pathway / negative regulation of cell migration / Downregulation of SMAD2/3:SMAD4 transcriptional activity / cellular response to leukemia inhibitory factor / Degradation of AXIN / SMAD2/SMAD3:SMAD4 heterotrimer regulates transcription / Regulation of RUNX3 expression and activity / Hedgehog 'on' state / negative regulation of transforming growth factor beta receptor signaling pathway / beta-catenin binding / fibrillar center / UCH proteinases / Interferon gamma signaling / ubiquitin-protein transferase activity / Antigen processing: Ubiquitination & Proteasome degradation / ubiquitin protein ligase activity / transcription corepressor activity / positive regulation of canonical Wnt signaling pathway / positive regulation of proteasomal ubiquitin-dependent protein catabolic process / ubiquitin-dependent protein catabolic process / proteasome-mediated ubiquitin-dependent protein catabolic process / cell differentiation / Ub-specific processing proteases / protein ubiquitination / protein stabilization / nuclear speck / ciliary basal body / membrane raft / negative regulation of DNA-templated transcription / ubiquitin protein ligase binding / centrosome / regulation of transcription by RNA polymerase II / chromatin / negative regulation of transcription by RNA polymerase II / protein-containing complex / nucleoplasm / metal ion binding / identical protein binding / nucleus / plasma membrane / cytosol / cytoplasm類似検索 - 分子機能 MAD homology, MH1 / Dwarfin / SMAD MH1 domain superfamily / MAD homology domain 1 (MH1) profile. / SMAD domain, Dwarfin-type / MH2 domain / MAD homology domain 2 (MH2) profile. / Domain B in dwarfin family proteins / MAD homology 1, Dwarfin-type / MH1 domain ...MAD homology, MH1 / Dwarfin / SMAD MH1 domain superfamily / MAD homology domain 1 (MH1) profile. / SMAD domain, Dwarfin-type / MH2 domain / MAD homology domain 2 (MH2) profile. / Domain B in dwarfin family proteins / MAD homology 1, Dwarfin-type / MH1 domain / Domain A in dwarfin family proteins / E3 ubiquitin-protein ligase, SMURF1 type / SMAD-like domain superfamily / : / HECT domain / HECT, E3 ligase catalytic domain / HECT-domain (ubiquitin-transferase) / HECT domain profile. / Domain Homologous to E6-AP Carboxyl Terminus with / SMAD/FHA domain superfamily / Protein kinase C conserved region 2 (CalB) / C2 domain / WW domain / WW/rsp5/WWP domain signature. / C2 domain / C2 domain profile. / WW domain superfamily / WW/rsp5/WWP domain profile. / Domain with 2 conserved Trp (W) residues / WW domain / C2 domain superfamily類似検索 - ドメイン・相同性 Mothers against decapentaplegic homolog 7 / E3 ubiquitin-protein ligase SMURF2類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 | 溶液NMR / torsion angle dynamics |
|---|
 データ登録者 データ登録者 | Macias, M.J. / Aragon, E. / Goerner, N. / Xi, Q. / Lopes, T. / Gao, S. / Massague, J. |
|---|
 引用 引用 |  ジャーナル: Structure / 年: 2012 ジャーナル: Structure / 年: 2012
タイトル: Structural Basis for the Versatile Interactions of Smad7 with Regulator WW Domains in TGF-beta Pathways.
著者: Aragon, E. / Goerner, N. / Xi, Q. / Gomes, T. / Gao, S. / Massague, J. / Macias, M.J. |
|---|
| 履歴 | | 登録 | 2012年6月4日 | 登録サイト: BMRB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2012年11月21日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2024年5月1日 | Group: Data collection / Database references
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_nmr_software / pdbx_nmr_spectrometer
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_nmr_software.name / _pdbx_nmr_spectrometer.model |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) データ登録者
データ登録者 引用
引用 ジャーナル: Structure / 年: 2012
ジャーナル: Structure / 年: 2012 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 2ltz.cif.gz
2ltz.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb2ltz.ent.gz
pdb2ltz.ent.gz PDB形式
PDB形式 2ltz.json.gz
2ltz.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 2ltz_validation.pdf.gz
2ltz_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 2ltz_full_validation.pdf.gz
2ltz_full_validation.pdf.gz 2ltz_validation.xml.gz
2ltz_validation.xml.gz 2ltz_validation.cif.gz
2ltz_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/lt/2ltz
https://data.pdbj.org/pub/pdb/validation_reports/lt/2ltz ftp://data.pdbj.org/pub/pdb/validation_reports/lt/2ltz
ftp://data.pdbj.org/pub/pdb/validation_reports/lt/2ltz リンク
リンク 集合体
集合体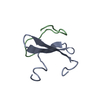
 要素
要素 Homo sapiens (ヒト) / 遺伝子: SMURF2 / プラスミド: petM11 / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: SMURF2 / プラスミド: petM11 / 発現宿主: 
 Homo sapiens (ヒト) / 参照: UniProt: O15105
Homo sapiens (ヒト) / 参照: UniProt: O15105 試料調製
試料調製 解析
解析 ムービー
ムービー コントローラー
コントローラー



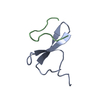
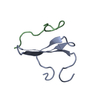

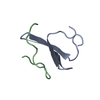







 PDBj
PDBj










 HSQC
HSQC