+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1jan | ||||||
|---|---|---|---|---|---|---|---|
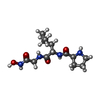
| タイトル | COMPLEX OF PRO-LEU-GLY-HYDROXYLAMINE WITH THE CATALYTIC DOMAIN OF MATRIX METALLO PROTEINASE-8 (PHE79 FORM) | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | HYDROLASE/HYDROLASE INHIBITOR / METALLOPROTEASE / ZINC-ENDOPEPTIDASE / METZINCINS / HYDROLASE-HYDROLASE INHIBITOR COMPLEX | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報neutrophil collagenase / tumor necrosis factor binding / positive regulation of microglial cell activation / positive regulation of neuroinflammatory response / positive regulation of tumor necrosis factor-mediated signaling pathway / Activation of Matrix Metalloproteinases / endodermal cell differentiation / Collagen degradation / collagen catabolic process / extracellular matrix disassembly ...neutrophil collagenase / tumor necrosis factor binding / positive regulation of microglial cell activation / positive regulation of neuroinflammatory response / positive regulation of tumor necrosis factor-mediated signaling pathway / Activation of Matrix Metalloproteinases / endodermal cell differentiation / Collagen degradation / collagen catabolic process / extracellular matrix disassembly / Degradation of the extracellular matrix / extracellular matrix organization / metalloendopeptidase activity / specific granule lumen / positive regulation of tumor necrosis factor production / tertiary granule lumen / peptidase activity / : / cellular response to lipopolysaccharide / endopeptidase activity / serine-type endopeptidase activity / Neutrophil degranulation / proteolysis / extracellular space / extracellular region / zinc ion binding 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / 解像度: 2.5 Å X線回折 / 解像度: 2.5 Å | ||||||
 データ登録者 データ登録者 | Reinemer, P. / Grams, F. / Huber, R. / Kleine, T. / Schnierer, S. / Pieper, M. / Tschesche, H. / Bode, W. | ||||||
 引用 引用 |  ジャーナル: FEBS Lett. / 年: 1994 ジャーナル: FEBS Lett. / 年: 1994タイトル: Structural implications for the role of the N terminus in the 'superactivation' of collagenases. A crystallographic study. 著者: Reinemer, P. / Grams, F. / Huber, R. / Kleine, T. / Schnierer, S. / Piper, M. / Tschesche, H. / Bode, W. #1:  ジャーナル: Eur.J.Biochem. / 年: 1995 ジャーナル: Eur.J.Biochem. / 年: 1995タイトル: X-Ray Structures of Human Neutrophil Collagenase Complexed with Peptide Hydroxamate and Peptide Thiol Inhibitors. Implications for Substrate Binding and Rational Drug Design 著者: Grams, F. / Reinemer, P. / Powers, J.C. / Kleine, T. / Pieper, M. / Tschesche, H. / Huber, R. / Bode, W. #2:  ジャーナル: Embo J. / 年: 1994 ジャーナル: Embo J. / 年: 1994タイトル: The X-Ray Crystal Structure of the Catalytic Domain of Human Neutrophil Collagenase Inhibited by a Substrate Analogue Reveals the Essentials for Catalysis and Specificity 著者: Bode, W. / Reinemer, P. / Huber, R. / Kleine, T. / Schnierer, S. / Tschesche, H. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1jan.cif.gz 1jan.cif.gz | 58.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1jan.ent.gz pdb1jan.ent.gz | 42.5 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1jan.json.gz 1jan.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1jan_validation.pdf.gz 1jan_validation.pdf.gz | 376.1 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1jan_full_validation.pdf.gz 1jan_full_validation.pdf.gz | 379.5 KB | 表示 | |
| XML形式データ |  1jan_validation.xml.gz 1jan_validation.xml.gz | 5.3 KB | 表示 | |
| CIF形式データ |  1jan_validation.cif.gz 1jan_validation.cif.gz | 7.9 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ja/1jan https://data.pdbj.org/pub/pdb/validation_reports/ja/1jan ftp://data.pdbj.org/pub/pdb/validation_reports/ja/1jan ftp://data.pdbj.org/pub/pdb/validation_reports/ja/1jan | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 18258.918 Da / 分子数: 1 / 断片: CATALYTIC DOMAIN, RESIDUES 79 - 242 / 由来タイプ: 組換発現 詳細: MMP-8 IS IDENTICAL TO THE HUMAN NEUTROPHIL COLLAGENASE 由来: (組換発現)  Homo sapiens (ヒト) / Cell: NEUTROPHILS / 発現宿主: Homo sapiens (ヒト) / Cell: NEUTROPHILS / 発現宿主:  | ||||
|---|---|---|---|---|---|
| #2: タンパク質・ペプチド | | ||||
| #3: 化合物 | | #4: 化合物 | #5: 水 | ChemComp-HOH / | |
-実験情報
-実験
| 実験 | 手法:  X線回折 X線回折 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.37 Å3/Da / 溶媒含有率: 41 % | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶 | *PLUS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 結晶化 | *PLUS 温度: 22 ℃ / pH: 6 / 手法: 蒸気拡散法, ハンギングドロップ法 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj