+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1hbm | ||||||
|---|---|---|---|---|---|---|---|
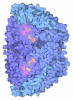
| タイトル | METHYL-COENZYME M REDUCTASE ENZYME PRODUCT COMPLEX | ||||||
 要素 要素 | (METHYL-COENZYME M REDUCTASE I ...) x 3 | ||||||
 キーワード キーワード | METHANOGENESIS / BIOLOGICAL METHANOGENESIS / NI-ENZYME / OXIDOREDUCTASE | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報coenzyme-B sulfoethylthiotransferase / coenzyme-B sulfoethylthiotransferase activity / methanogenesis / metal ion binding / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |   METHANOTHERMOBACTER THERMAUTOTROPHICUS (古細菌) METHANOTHERMOBACTER THERMAUTOTROPHICUS (古細菌) | ||||||
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 1.8 Å 分子置換 / 解像度: 1.8 Å | ||||||
 データ登録者 データ登録者 | Ermler, U. / Grabarse, W. | ||||||
 引用 引用 |  ジャーナル: J.Mol.Biol. / 年: 2001 ジャーナル: J.Mol.Biol. / 年: 2001タイトル: On the Mechanism of Biological Methane Formation: Structural Evidence for Conformational Changes in Methyl-Coenzyme M Reductase Upon Substrate Binding 著者: Grabarse, W. / Mahlert, F. / Duin, E.C. / Goubeaud, M. / Shima, S. / Thauer, R.K. / Lamzin, V. / Ermler, U. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1hbm.cif.gz 1hbm.cif.gz | 548.6 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1hbm.ent.gz pdb1hbm.ent.gz | 437.3 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1hbm.json.gz 1hbm.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1hbm_validation.pdf.gz 1hbm_validation.pdf.gz | 729.9 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1hbm_full_validation.pdf.gz 1hbm_full_validation.pdf.gz | 771.7 KB | 表示 | |
| XML形式データ |  1hbm_validation.xml.gz 1hbm_validation.xml.gz | 54.6 KB | 表示 | |
| CIF形式データ |  1hbm_validation.cif.gz 1hbm_validation.cif.gz | 91 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/hb/1hbm https://data.pdbj.org/pub/pdb/validation_reports/hb/1hbm ftp://data.pdbj.org/pub/pdb/validation_reports/hb/1hbm ftp://data.pdbj.org/pub/pdb/validation_reports/hb/1hbm | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
| ||||||||
| 非結晶学的対称性 (NCS) | NCS oper: (Code: given Matrix: (0.6268, -0.7779, 0.0458), ベクター: |
- 要素
要素
-METHYL-COENZYME M REDUCTASE I ... , 3種, 6分子 ADBECF
| #1: タンパク質 | 分子量: 60508.469 Da / 分子数: 2 / 由来タイプ: 天然 由来: (天然)   METHANOTHERMOBACTER THERMAUTOTROPHICUS (古細菌) METHANOTHERMOBACTER THERMAUTOTROPHICUS (古細菌)細胞内の位置: CYTOPLASM / 株: MARBURG / 参照: UniProt: P11558 #2: タンパク質 | 分子量: 47148.477 Da / 分子数: 2 / 由来タイプ: 天然 由来: (天然)   METHANOTHERMOBACTER THERMAUTOTROPHICUS (古細菌) METHANOTHERMOBACTER THERMAUTOTROPHICUS (古細菌)細胞内の位置: CYTOPLASM / 株: MARBURG / 参照: UniProt: P11560 #3: タンパク質 | 分子量: 28666.039 Da / 分子数: 2 / 由来タイプ: 天然 / 詳細: MCR-OX-SILENT STATE, ENZYME-SUBSTRATE COMPLEX 由来: (天然)   METHANOTHERMOBACTER THERMAUTOTROPHICUS (古細菌) METHANOTHERMOBACTER THERMAUTOTROPHICUS (古細菌)細胞内の位置: CYTOPLASM / 株: MARBURG / 参照: UniProt: P11562 |
|---|
-非ポリマー , 8種, 2124分子 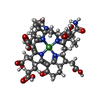
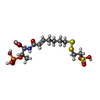













| #4: 化合物 | | #5: 化合物 | #6: 化合物 | ChemComp-GOL / #7: 化合物 | ChemComp-NA / #8: 化合物 | #9: 化合物 | ChemComp-MG / #10: 化合物 | ChemComp-ZN / | #11: 水 | ChemComp-HOH / | |
|---|
-詳細
| 構成要素の詳細 | CATALYZES THE FINAL STEP IN METHANOGEN| 配列の詳細 | REFERENCE: 1 RESIDUE IS LACKING IN THE C-TERMINUS AND THE N-TERMINUS, C AND N-TERMINUS ARE VISIBLE ...REFERENCE: 1 RESIDUE IS LACKING IN THE C-TERMINUS AND THE N-TERMINUS, C AND N-TERMINUS ARE VISIBLE IN THE CRYSTAL STRUCTURE. MET 1 WAS CLEARLY SHOWN NOT TO BE PRESENT. | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 3.9 Å3/Da / 溶媒含有率: 31 % | ||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | pH: 7.5 詳細: 25% PEG 400, 0.2 M NACL, 20 MG/ML FINAL PROTEIN CONC, 0.2 M MGCL, 0.1 M HEPES PH 7.5 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 結晶化 | *PLUS 温度: 4 ℃ / 手法: 蒸気拡散法, ハンギングドロップ法 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU / 波長: 1.54 回転陽極 / タイプ: RIGAKU / 波長: 1.54 |
| 検出器 | タイプ: MAR scanner 345 mm plate / 検出器: IMAGE PLATE / 日付: 1998年4月15日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.54 Å / 相対比: 1 |
| 反射 | 解像度: 1.8→10 Å / Num. obs: 198635 / % possible obs: 91.8 % / 冗長度: 4.2 % / Rmerge(I) obs: 0.088 / Rsym value: 0.08 / Net I/σ(I): 8.21 |
| 反射 シェル | 解像度: 1.8→1.82 Å / 冗長度: 2 % / Rmerge(I) obs: 0.18 / Mean I/σ(I) obs: 3.9 / Rsym value: 0.19 / % possible all: 74.9 |
| 反射 シェル | *PLUS 最高解像度: 1.8 Å / % possible obs: 74.9 % / Rmerge(I) obs: 0.183 |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 1MRO 解像度: 1.8→10 Å / 交差検証法: THROUGHOUT / σ(F): 0
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.8→10 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称: REFMAC / 分類: refinement | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | *PLUS Rfactor obs: 0.164 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS |
 ムービー
ムービー コントローラー
コントローラー

















 PDBj
PDBj