+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-20442 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of human NatE complex (NatA/Naa50) | |||||||||
 マップデータ マップデータ | NatE complex (NatA/Naa50) | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | NatA / Naa50 / NatE / TRANSFERASE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報negative regulation of maintenance of mitotic sister chromatid cohesion, centromeric / mitotic sister chromatid cohesion, centromeric / protein-N-terminal-glutamate acetyltransferase activity / N-terminal methionine Nalpha-acetyltransferase NatE / N-terminal amino-acid Nalpha-acetyltransferase NatA / N-terminal protein amino acid acetylation / NatA complex / protein N-terminal-serine acetyltransferase activity / protein N-terminal-methionine acetyltransferase activity / protein-N-terminal-alanine acetyltransferase activity ...negative regulation of maintenance of mitotic sister chromatid cohesion, centromeric / mitotic sister chromatid cohesion, centromeric / protein-N-terminal-glutamate acetyltransferase activity / N-terminal methionine Nalpha-acetyltransferase NatE / N-terminal amino-acid Nalpha-acetyltransferase NatA / N-terminal protein amino acid acetylation / NatA complex / protein N-terminal-serine acetyltransferase activity / protein N-terminal-methionine acetyltransferase activity / protein-N-terminal-alanine acetyltransferase activity / protein-N-terminal amino-acid acetyltransferase activity / internal protein amino acid acetylation / acetyltransferase activator activity / N-acetyltransferase activity / histone H4 acetyltransferase activity / establishment of mitotic sister chromatid cohesion / protein-lysine-acetyltransferase activity / mitotic sister chromatid cohesion / protein acetylation / chromosome organization / 転移酵素; アシル基を移すもの; アミノアシル基以外のアシル基を移すもの / ribosome binding / angiogenesis / transcription regulator complex / cell differentiation / protein stabilization / nuclear body / intracellular membrane-bounded organelle / negative regulation of apoptotic process / positive regulation of DNA-templated transcription / nucleolus / RNA binding / extracellular exosome / nucleus / membrane / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.02 Å | |||||||||
 データ登録者 データ登録者 | Deng S / Marmorstein R | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2020 ジャーナル: Nat Commun / 年: 2020タイトル: Molecular basis for N-terminal acetylation by human NatE and its modulation by HYPK. 著者: Sunbin Deng / Nina McTiernan / Xuepeng Wei / Thomas Arnesen / Ronen Marmorstein /   要旨: The human N-terminal acetyltransferase E (NatE) contains NAA10 and NAA50 catalytic, and NAA15 auxiliary subunits and associates with HYPK, a protein with intrinsic NAA10 inhibitory activity. NatE co- ...The human N-terminal acetyltransferase E (NatE) contains NAA10 and NAA50 catalytic, and NAA15 auxiliary subunits and associates with HYPK, a protein with intrinsic NAA10 inhibitory activity. NatE co-translationally acetylates the N-terminus of half the proteome to mediate diverse biological processes, including protein half-life, localization, and interaction. The molecular basis for how NatE and HYPK cooperate is unknown. Here, we report the cryo-EM structures of human NatE and NatE/HYPK complexes and associated biochemistry. We reveal that NAA50 and HYPK exhibit negative cooperative binding to NAA15 in vitro and in human cells by inducing NAA15 shifts in opposing directions. NAA50 and HYPK each contribute to NAA10 activity inhibition through structural alteration of the NAA10 substrate-binding site. NAA50 activity is increased through NAA15 tethering, but is inhibited by HYPK through structural alteration of the NatE substrate-binding site. These studies reveal the molecular basis for coordinated N-terminal acetylation by NatE and HYPK. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_20442.map.gz emd_20442.map.gz | 7.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-20442-v30.xml emd-20442-v30.xml emd-20442.xml emd-20442.xml | 16.1 KB 16.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_20442.png emd_20442.png | 133 KB | ||
| Filedesc metadata |  emd-20442.cif.gz emd-20442.cif.gz | 6.6 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-20442 http://ftp.pdbj.org/pub/emdb/structures/EMD-20442 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-20442 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-20442 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_20442_validation.pdf.gz emd_20442_validation.pdf.gz | 364.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_20442_full_validation.pdf.gz emd_20442_full_validation.pdf.gz | 364.1 KB | 表示 | |
| XML形式データ |  emd_20442_validation.xml.gz emd_20442_validation.xml.gz | 6.3 KB | 表示 | |
| CIF形式データ |  emd_20442_validation.cif.gz emd_20442_validation.cif.gz | 7.2 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20442 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20442 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20442 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20442 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_20442.map.gz / 形式: CCP4 / 大きさ: 83.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_20442.map.gz / 形式: CCP4 / 大きさ: 83.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
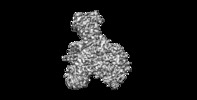
| 注釈 | NatE complex (NatA/Naa50) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.832 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : human NatE complex
| 全体 | 名称: human NatE complex |
|---|---|
| 要素 |
|
-超分子 #1: human NatE complex
| 超分子 | 名称: human NatE complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#3 |
|---|
-超分子 #2: N-alpha-acetyltransferase 50
| 超分子 | 名称: N-alpha-acetyltransferase 50 / タイプ: complex / ID: 2 / 親要素: 1 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-超分子 #3: N-alpha-acetyltransferase 15, NatA auxiliary subunit, N-alpha-ace...
| 超分子 | 名称: N-alpha-acetyltransferase 15, NatA auxiliary subunit, N-alpha-acetyltransferase 10 タイプ: complex / ID: 3 / 親要素: 1 / 含まれる分子: #2-#3 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: N-alpha-acetyltransferase 50
| 分子 | 名称: N-alpha-acetyltransferase 50 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO EC番号: N-terminal methionine Nalpha-acetyltransferase NatE |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 19.427373 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MKGSRIELGD VTPHNIKQLK RLNQVIFPVS YNDKFYKDVL EVGELAKLAY FNDIAVGAVC CRVDHSQNQK RLYIMTLGCL APYRRLGIG TKMLNHVLNI CEKDGTFDNI YLHVQISNES AIDFYRKFGF EIIETKKNYY KRIEPADAHV LQKNLKVPSG Q NADVQKTD N UniProtKB: N-alpha-acetyltransferase 50 |
-分子 #2: N-alpha-acetyltransferase 15, NatA auxiliary subunit
| 分子 | 名称: N-alpha-acetyltransferase 15, NatA auxiliary subunit タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 101.427562 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MPAVSLPPKE NALFKRILRC YEHKQYRNGL KFCKQILSNP KFAEHGETLA MKGLTLNCLG KKEEAYELVR RGLRNDLKSH VCWHVYGLL QRSDKKYDEA IKCYRNALKW DKDNLQILRD LSLLQIQMRD LEGYRETRYQ LLQLRPAQRA SWIGYAIAYH L LEDYEMAA ...文字列: MPAVSLPPKE NALFKRILRC YEHKQYRNGL KFCKQILSNP KFAEHGETLA MKGLTLNCLG KKEEAYELVR RGLRNDLKSH VCWHVYGLL QRSDKKYDEA IKCYRNALKW DKDNLQILRD LSLLQIQMRD LEGYRETRYQ LLQLRPAQRA SWIGYAIAYH L LEDYEMAA KILEEFRKTQ QTSPDKVDYE YSELLLYQNQ VLREAGLYRE ALEHLCTYEK QICDKLAVEE TKGELLLQLC RL EDAADVY RGLQERNPEN WAYYKGLEKA LKPANMLERL KIYEEAWTKY PRGLVPRRLP LNFLSGEKFK ECLDKFLRMN FSK GCPPVF NTLRSLYKDK EKVAIIEELV VGYETSLKSC RLFNPNDDGK EEPPTTLLWV QYYLAQHYDK IGQPSIALEY INTA IESTP TLIELFLVKA KIYKHAGNIK EAARWMDEAQ ALDTADRFIN SKCAKYMLKA NLIKEAEEMC SKFTREGTSA VENLN EMQC MWFQTECAQA YKAMNKFGEA LKKCHEIERH FIEITDDQFD FHTYCMRKIT LRSYVDLLKL EDVLRQHPFY FKAARI AIE IYLKLHDNPL TDENKEHEAD TANMSDKELK KLRNKQRRAQ KKAQIEEEKK NAEKEKQQRN QKKKKDDDDE EIGGPKE EL IPEKLAKVET PLEEAIKFLT PLKNLVKNKI ETHLFAFEIY FRKEKFLLML QSVKRAFAID SSHPWLHECM IRLFNTAV C ESKDLSDTVR TVLKQEMNRL FGATNPKNFN ETFLKRNSDS LPHRLSAAKM VYYLDPSSQK RAIELATTLD ESLTNRNLQ TCMEVLEALY DGSLGDCKEA AEIYRANCHK LFPYALAFMP PGYEEDMKIT VNGDSSAEAE ELANEI UniProtKB: N-alpha-acetyltransferase 15, NatA auxiliary subunit |
-分子 #3: N-alpha-acetyltransferase 10
| 分子 | 名称: N-alpha-acetyltransferase 10 / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO EC番号: N-terminal amino-acid Nalpha-acetyltransferase NatA |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 26.522602 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: (ACE)MNIRNARPE DLMNMQHCNL LCLPENYQMK YYFYHGLSWP QLSYIAEDEN GKIVGYVLAK MEEDPDDVPH GHITSL AVK RSHRRLGLAQ KLMDQASRAM IENFNAKYVS LHVRKSNRAA LHLYSNTLNF QISEVEPKYY ADGEDAYAMK RDLTQMA DE ...文字列: (ACE)MNIRNARPE DLMNMQHCNL LCLPENYQMK YYFYHGLSWP QLSYIAEDEN GKIVGYVLAK MEEDPDDVPH GHITSL AVK RSHRRLGLAQ KLMDQASRAM IENFNAKYVS LHVRKSNRAA LHLYSNTLNF QISEVEPKYY ADGEDAYAMK RDLTQMA DE LRRHLELKEK GRHVVLGAIE NKVESKGNSP PSSGEACREE KGLAAEDSGG DSKDLSEVSE TTESTDVKDS SEASDSAS UniProtKB: N-alpha-acetyltransferase 10 |
-分子 #4: ACETYL COENZYME *A
| 分子 | 名称: ACETYL COENZYME *A / タイプ: ligand / ID: 4 / コピー数: 2 / 式: ACO |
|---|---|
| 分子量 | 理論値: 809.571 Da |
| Chemical component information |  ChemComp-ACO: |
-分子 #5: INOSITOL HEXAKISPHOSPHATE
| 分子 | 名称: INOSITOL HEXAKISPHOSPHATE / タイプ: ligand / ID: 5 / コピー数: 1 / 式: IHP |
|---|---|
| 分子量 | 理論値: 660.035 Da |
| Chemical component information |  ChemComp-IHP: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1.0 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7 構成要素:
| ||||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 120 sec. | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 289 K / 装置: FEI VITROBOT MARK II |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 1.6 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: PDB ENTRY PDBモデル - PDB ID: |
|---|---|
| 最終 再構成 | 想定した対称性 - 点群: C1 (非対称) / 解像度のタイプ: BY AUTHOR / 解像度: 3.02 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 353541 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
 ムービー
ムービー コントローラー
コントローラー





















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)