登録情報 データベース : EMDB / ID : EMD-14196タイトル Cryo-EM map of human telomerase-DNA-TPP1 complex (sharpened) Post-processed map of DNA-bound human telomerase in complex with TPP1 複合体 : Complex of telomeric DNA-bound human telomerase with TPP1複合体 : Telomeric DNA複合体 : Telomerase reverse transcriptase and telomeric RNAタンパク質・ペプチド : Telomerase reverse transcriptaseタンパク質・ペプチド : Adrenocortical dysplasia homolog (Mouse), isoform CRA_a複合体 : HistonesRNA : human telomerase RNAタンパク質・ペプチド : Histone H2A複合体 : TPP1 / / / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
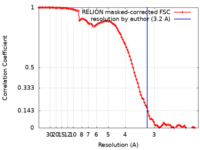
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / / 解像度 : 3.2 Å Sekne Z / Ghanim GE 資金援助 Organization Grant number 国 UK Research and Innovation (UKRI) MC_UP_1201/19 Jane Coffin Childs Postdoctoral Fellowship
ジャーナル : Science / 年 : 2022タイトル : Structural basis of human telomerase recruitment by TPP1-POT1.著者 : Zala Sekne / George E Ghanim / Anne-Marie M van Roon / Thi Hoang Duong Nguyen / 要旨 : Telomerase maintains genome stability by extending the 3' telomeric repeats at eukaryotic chromosome ends, thereby counterbalancing progressive loss caused by incomplete genome replication. In ... Telomerase maintains genome stability by extending the 3' telomeric repeats at eukaryotic chromosome ends, thereby counterbalancing progressive loss caused by incomplete genome replication. In mammals, telomerase recruitment to telomeres is mediated by TPP1, which assembles as a heterodimer with POT1. We report structures of DNA-bound telomerase in complex with TPP1 and with TPP1-POT1 at 3.2- and 3.9-angstrom resolution, respectively. Our structures define interactions between telomerase and TPP1-POT1 that are crucial for telomerase recruitment to telomeres. The presence of TPP1-POT1 stabilizes the DNA, revealing an unexpected path by which DNA exits the telomerase active site and a DNA anchor site on telomerase that is important for telomerase processivity. Our findings rationalize extensive prior genetic and biochemical findings and provide a framework for future mechanistic work on telomerase regulation. 履歴 登録 2022年1月26日 - ヘッダ(付随情報) 公開 2022年3月2日 - マップ公開 2022年3月2日 - 更新 2024年7月17日 - 現状 2024年7月17日 処理サイト : PDBe / 状態 : 公開
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 マップデータ
マップデータ 試料
試料 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) データ登録者
データ登録者 英国,
英国,  米国, 2件
米国, 2件  引用
引用 ジャーナル: Science / 年: 2022
ジャーナル: Science / 年: 2022
 構造の表示
構造の表示 ムービービューア
ムービービューア SurfView
SurfView Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク emd_14196.map.gz
emd_14196.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-14196-v30.xml
emd-14196-v30.xml emd-14196.xml
emd-14196.xml EMDBヘッダ
EMDBヘッダ emd_14196_fsc.xml
emd_14196_fsc.xml FSCデータファイル
FSCデータファイル emd_14196.png
emd_14196.png emd_14196_msk_1.map
emd_14196_msk_1.map マスクマップ
マスクマップ emd-14196.cif.gz
emd-14196.cif.gz emd_14196_half_map_1.map.gz
emd_14196_half_map_1.map.gz emd_14196_half_map_2.map.gz
emd_14196_half_map_2.map.gz http://ftp.pdbj.org/pub/emdb/structures/EMD-14196
http://ftp.pdbj.org/pub/emdb/structures/EMD-14196 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14196
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14196 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_14196.map.gz / 形式: CCP4 / 大きさ: 83.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_14196.map.gz / 形式: CCP4 / 大きさ: 83.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) emd_14196_msk_1.map
emd_14196_msk_1.map 試料の構成要素
試料の構成要素 解析
解析 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN
 ムービー
ムービー コントローラー
コントローラー



















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)






































 Spodoptera (蝶・蛾)
Spodoptera (蝶・蛾)