+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-12268 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Type 2AB alpha-synuclein filament seeded in vitro by filaments purified from Multiple Systems Atrophy Case 1 | |||||||||||||||
 マップデータ マップデータ | Type 2AB alpha-synuclein filament seeded in vitro by filaments purified from Multiple Systems Atrophy Case 1 | |||||||||||||||
 試料 試料 |
| |||||||||||||||
 キーワード キーワード | Amyloid / Multiple System Atrophy / Neurodegeneration / alpha-synuclein / filament / PROTEIN FIBRIL | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報negative regulation of mitochondrial electron transport, NADH to ubiquinone / : / neutral lipid metabolic process / regulation of acyl-CoA biosynthetic process / negative regulation of dopamine uptake involved in synaptic transmission / negative regulation of norepinephrine uptake / response to desipramine / positive regulation of SNARE complex assembly / positive regulation of hydrogen peroxide catabolic process / supramolecular fiber ...negative regulation of mitochondrial electron transport, NADH to ubiquinone / : / neutral lipid metabolic process / regulation of acyl-CoA biosynthetic process / negative regulation of dopamine uptake involved in synaptic transmission / negative regulation of norepinephrine uptake / response to desipramine / positive regulation of SNARE complex assembly / positive regulation of hydrogen peroxide catabolic process / supramolecular fiber / regulation of synaptic vesicle recycling / negative regulation of chaperone-mediated autophagy / mitochondrial membrane organization / regulation of reactive oxygen species biosynthetic process / negative regulation of platelet-derived growth factor receptor signaling pathway / positive regulation of protein localization to cell periphery / negative regulation of exocytosis / regulation of glutamate secretion / dopamine biosynthetic process / response to iron(II) ion / SNARE complex assembly / positive regulation of neurotransmitter secretion / negative regulation of dopamine metabolic process / regulation of macrophage activation / positive regulation of inositol phosphate biosynthetic process / regulation of norepinephrine uptake / negative regulation of microtubule polymerization / regulation of locomotion / synaptic vesicle transport / transporter regulator activity / synaptic vesicle priming / dopamine uptake involved in synaptic transmission / protein kinase inhibitor activity / regulation of dopamine secretion / mitochondrial ATP synthesis coupled electron transport / dynein complex binding / negative regulation of thrombin-activated receptor signaling pathway / positive regulation of receptor recycling / cuprous ion binding / nuclear outer membrane / response to magnesium ion / positive regulation of exocytosis / synaptic vesicle exocytosis / positive regulation of endocytosis / kinesin binding / synaptic vesicle endocytosis / enzyme inhibitor activity / cysteine-type endopeptidase inhibitor activity / regulation of presynapse assembly / response to type II interferon / negative regulation of serotonin uptake / alpha-tubulin binding / beta-tubulin binding / phospholipase binding / behavioral response to cocaine / supramolecular fiber organization / phospholipid metabolic process / cellular response to fibroblast growth factor stimulus / inclusion body / axon terminus / Hsp70 protein binding / cellular response to epinephrine stimulus / response to interleukin-1 / regulation of microtubule cytoskeleton organization / cellular response to copper ion / positive regulation of release of sequestered calcium ion into cytosol / adult locomotory behavior / SNARE binding / excitatory postsynaptic potential / protein tetramerization / phosphoprotein binding / microglial cell activation / ferrous iron binding / fatty acid metabolic process / regulation of long-term neuronal synaptic plasticity / synapse organization / protein destabilization / PKR-mediated signaling / phospholipid binding / receptor internalization / tau protein binding / long-term synaptic potentiation / terminal bouton / positive regulation of inflammatory response / synaptic vesicle membrane / actin cytoskeleton / growth cone / actin binding / cellular response to oxidative stress / neuron apoptotic process / cell cortex / histone binding / response to lipopolysaccharide / microtubule binding / chemical synaptic transmission / amyloid fibril formation / molecular adaptor activity / negative regulation of neuron apoptotic process / mitochondrial outer membrane / oxidoreductase activity 類似検索 - 分子機能 | |||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||
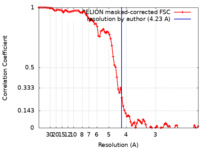
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 4.23 Å | |||||||||||||||
 データ登録者 データ登録者 | Lovestam SKA / Schweighauser M | |||||||||||||||
| 資金援助 |  英国, 英国,  日本, 4件 日本, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: FEBS Open Bio / 年: 2021 ジャーナル: FEBS Open Bio / 年: 2021タイトル: Seeded assembly in vitro does not replicate the structures of α-synuclein filaments from multiple system atrophy. 著者: Sofia Lövestam / Manuel Schweighauser / Tomoyasu Matsubara / Shigeo Murayama / Taisuke Tomita / Takashi Ando / Kazuko Hasegawa / Mari Yoshida / Airi Tarutani / Masato Hasegawa / Michel ...著者: Sofia Lövestam / Manuel Schweighauser / Tomoyasu Matsubara / Shigeo Murayama / Taisuke Tomita / Takashi Ando / Kazuko Hasegawa / Mari Yoshida / Airi Tarutani / Masato Hasegawa / Michel Goedert / Sjors H W Scheres /   要旨: The propagation of conformational strains by templated seeding is central to the prion concept. Seeded assembly of α-synuclein into filaments is believed to underlie the prion-like spreading of ...The propagation of conformational strains by templated seeding is central to the prion concept. Seeded assembly of α-synuclein into filaments is believed to underlie the prion-like spreading of protein inclusions in a number of human neurodegenerative diseases, including Parkinson's disease, dementia with Lewy bodies (DLB) and multiple system atrophy (MSA). We previously determined the atomic structures of α-synuclein filaments from the putamen of five individuals with MSA. Here, we used filament preparations from three of these brains for the in vitro seeded assembly of recombinant human α-synuclein. We find that the structures of the seeded assemblies differ from those of the seeds, suggesting that additional, as yet unknown, factors play a role in the propagation of the seeds. Identification of these factors will be essential for understanding the prion-like spreading of α-synuclein proteinopathies. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_12268.map.gz emd_12268.map.gz | 1.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-12268-v30.xml emd-12268-v30.xml emd-12268.xml emd-12268.xml | 15.8 KB 15.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_12268_fsc.xml emd_12268_fsc.xml | 9.2 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_12268.png emd_12268.png | 88.8 KB | ||
| Filedesc metadata |  emd-12268.cif.gz emd-12268.cif.gz | 5.2 KB | ||
| その他 |  emd_12268_half_map_1.map.gz emd_12268_half_map_1.map.gz emd_12268_half_map_2.map.gz emd_12268_half_map_2.map.gz | 49.5 MB 49.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-12268 http://ftp.pdbj.org/pub/emdb/structures/EMD-12268 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-12268 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-12268 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_12268_validation.pdf.gz emd_12268_validation.pdf.gz | 709.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_12268_full_validation.pdf.gz emd_12268_full_validation.pdf.gz | 709.2 KB | 表示 | |
| XML形式データ |  emd_12268_validation.xml.gz emd_12268_validation.xml.gz | 16.1 KB | 表示 | |
| CIF形式データ |  emd_12268_validation.cif.gz emd_12268_validation.cif.gz | 21.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12268 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12268 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12268 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12268 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7ncjMC  7ncaC  7ncgC  7nchC  7nciC  7nckC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10640 (タイトル: Cryo-EM of Multiple System Atrophy seeded assembly of alpha-synuclein filaments EMPIAR-10640 (タイトル: Cryo-EM of Multiple System Atrophy seeded assembly of alpha-synuclein filamentsData size: 1.1 TB Data #1: Unaligned movies of alpha-synuclein filament seeded in vitro by filaments purified from Multiple Systems Atrophy Case 1 [micrographs - multiframe] Data #2: Unaligned movies of alpha-synuclein filament seeded in vitro by filaments purified from Multiple Systems Atrophy Case 2 [micrographs - multiframe] Data #3: Unaligned movies of alpha-synuclein filament seeded in vitro by filaments purified from Multiple Systems Atrophy Case 5 [micrographs - multiframe] Data #4: Type 1A particles after Bayesian polishing [picked particles - single frame - processed] Data #5: Type 2A particles after Bayesian polishing [picked particles - single frame - processed] Data #6: Type 1B particles after Bayesian polishing [picked particles - single frame - processed] Data #7: Type 2B particles after Bayesian polishing [picked particles - single frame - processed] Data #8: Type 2AB particles after Bayesian polishing [picked particles - single frame - processed] Data #9: Type 3 particles after Bayesian polishing [picked particles - single frame - processed]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_12268.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_12268.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Type 2AB alpha-synuclein filament seeded in vitro by filaments purified from Multiple Systems Atrophy Case 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.1 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
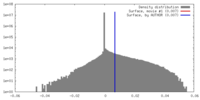
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-ハーフマップ: Type 2AB alpha-synuclein filament seeded in vitro by...
| ファイル | emd_12268_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Type 2AB alpha-synuclein filament seeded in vitro by filaments purified from Multiple Systems Atrophy Case 1, half map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
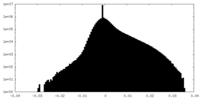
| 密度ヒストグラム |
-ハーフマップ: Type 2AB alpha-synuclein filament seeded in vitro by...
| ファイル | emd_12268_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Type 2AB alpha-synuclein filament seeded in vitro by filaments purified from Multiple Systems Atrophy Case 1, half map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
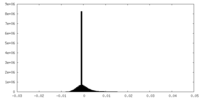
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Alpha synuclein filament
| 全体 | 名称: Alpha synuclein filament |
|---|---|
| 要素 |
|
-超分子 #1: Alpha synuclein filament
| 超分子 | 名称: Alpha synuclein filament / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Alpha-synuclein
| 分子 | 名称: Alpha-synuclein / タイプ: protein_or_peptide / ID: 1 / コピー数: 12 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 14.476108 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MDVFMKGLSK AKEGVVAAAE KTKQGVAEAA GKTKEGVLYV GSKTKEGVVH GVATVAEKTK EQVTNVGGAV VTGVTAVAQK TVEGAGSIA AATGFVKKDQ LGKNEEGAPQ EGILEDMPVD PDNEAYEMPS EEGYQDYEPE A UniProtKB: Alpha-synuclein |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 濃度 | 1 mg/mL |
|---|---|
| 緩衝液 | pH: 6.5 |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV / 詳細: LMB vitrobot IV. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 平均電子線量: 32.6 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 1.5 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー



















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)