+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-10418 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | CryoEM structure of human polycystin-2/PKD2 in UDM supplemented with PI(4,5)P2 | |||||||||
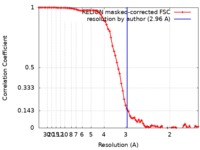
 マップデータ マップデータ | Postprocessed final map sharpened with a bfactor of -85A**2 and filtered to 2.96A | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | ION CHANNEL / TRANSIENT RECEPTOR POTENTIAL CHANNEL / POLYCYSTIC KIDNEY DISEASE / Structural Genomics / Structural Genomics Consortium / SGC / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報detection of nodal flow / metanephric smooth muscle tissue development / metanephric cortex development / metanephric cortical collecting duct development / metanephric distal tubule development / polycystin complex / mesonephric tubule development / mesonephric duct development / metanephric part of ureteric bud development / renal tubule morphogenesis ...detection of nodal flow / metanephric smooth muscle tissue development / metanephric cortex development / metanephric cortical collecting duct development / metanephric distal tubule development / polycystin complex / mesonephric tubule development / mesonephric duct development / metanephric part of ureteric bud development / renal tubule morphogenesis / determination of liver left/right asymmetry / HLH domain binding / metanephric ascending thin limb development / metanephric mesenchyme development / metanephric S-shaped body morphogenesis / basal cortex / renal artery morphogenesis / calcium-induced calcium release activity / migrasome / cilium organization / VxPx cargo-targeting to cilium / detection of mechanical stimulus / muscle alpha-actinin binding / regulation of calcium ion import / voltage-gated monoatomic ion channel activity / placenta blood vessel development / cellular response to hydrostatic pressure / cation channel complex / cellular response to fluid shear stress / outward rectifier potassium channel activity / actinin binding / cellular response to osmotic stress / non-motile cilium / determination of left/right symmetry / voltage-gated monoatomic cation channel activity / inorganic cation transmembrane transport / aorta development / neural tube development / motile cilium / voltage-gated sodium channel activity / ciliary membrane / branching involved in ureteric bud morphogenesis / protein heterotetramerization / negative regulation of G1/S transition of mitotic cell cycle / spinal cord development / positive regulation of phospholipase C-activating G protein-coupled receptor signaling pathway / cytoplasmic side of endoplasmic reticulum membrane / heart looping / centrosome duplication / voltage-gated potassium channel activity / cell surface receptor signaling pathway via JAK-STAT / potassium channel activity / embryonic placenta development / voltage-gated calcium channel activity / transcription regulator inhibitor activity / monoatomic cation channel activity / cytoskeletal protein binding / cellular response to cAMP / release of sequestered calcium ion into cytosol / potassium ion transmembrane transport / sodium ion transmembrane transport / cellular response to calcium ion / cytoplasmic vesicle membrane / liver development / basal plasma membrane / lumenal side of endoplasmic reticulum membrane / cellular response to reactive oxygen species / establishment of localization in cell / phosphoprotein binding / protein tetramerization / calcium ion transmembrane transport / Wnt signaling pathway / intracellular calcium ion homeostasis / calcium ion transport / mitotic spindle / positive regulation of nitric oxide biosynthetic process / cell-cell junction / lamellipodium / regulation of cell population proliferation / heart development / ATPase binding / basolateral plasma membrane / protein homotetramerization / transmembrane transporter binding / cell surface receptor signaling pathway / regulation of cell cycle / ciliary basal body / cilium / signaling receptor binding / negative regulation of cell population proliferation / calcium ion binding / positive regulation of gene expression / endoplasmic reticulum membrane / endoplasmic reticulum / Golgi apparatus / protein homodimerization activity / positive regulation of transcription by RNA polymerase II / extracellular exosome / identical protein binding / membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.96 Å | |||||||||
 データ登録者 データ登録者 | Wang Q / Pike ACW | |||||||||
| 資金援助 |  英国, 1件 英国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2020 ジャーナル: Structure / 年: 2020タイトル: Lipid Interactions of a Ciliary Membrane TRP Channel: Simulation and Structural Studies of Polycystin-2. 著者: Qinrui Wang / Robin A Corey / George Hedger / Prafulla Aryal / Mariana Grieben / Chady Nasrallah / Agnese Baronina / Ashley C W Pike / Jiye Shi / Elisabeth P Carpenter / Mark S P Sansom /  要旨: Polycystin-2 (PC2) is a transient receptor potential (TRP) channel present in ciliary membranes of the kidney. PC2 shares a transmembrane fold with other TRP channels, in addition to an extracellular ...Polycystin-2 (PC2) is a transient receptor potential (TRP) channel present in ciliary membranes of the kidney. PC2 shares a transmembrane fold with other TRP channels, in addition to an extracellular domain found in TRPP and TRPML channels. Using molecular dynamics (MD) simulations and cryoelectron microscopy we identify and characterize PIP and cholesterol interactions with PC2. PC2 is revealed to have a PIP binding site close to the equivalent vanilloid/lipid binding site in the TRPV1 channel. A 3.0-Å structure reveals a binding site for cholesterol on PC2. Cholesterol interactions with the channel at this site are characterized by MD simulations. The two classes of lipid binding sites are compared with sites observed in other TRPs and in Kv channels. These findings suggest PC2, in common with other ion channels, may be modulated by both PIPs and cholesterol, and position PC2 within an emerging model of the roles of lipids in the regulation and organization of ciliary membranes. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_10418.map.gz emd_10418.map.gz | 37.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-10418-v30.xml emd-10418-v30.xml emd-10418.xml emd-10418.xml | 23.3 KB 23.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_10418_fsc.xml emd_10418_fsc.xml | 7.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_10418.png emd_10418.png | 203 KB | ||
| マスクデータ |  emd_10418_msk_1.map emd_10418_msk_1.map | 40.6 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-10418.cif.gz emd-10418.cif.gz | 7.1 KB | ||
| その他 |  emd_10418_additional.map.gz emd_10418_additional.map.gz emd_10418_half_map_1.map.gz emd_10418_half_map_1.map.gz emd_10418_half_map_2.map.gz emd_10418_half_map_2.map.gz | 27.7 MB 27.9 MB 27.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-10418 http://ftp.pdbj.org/pub/emdb/structures/EMD-10418 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10418 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10418 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_10418_validation.pdf.gz emd_10418_validation.pdf.gz | 1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_10418_full_validation.pdf.gz emd_10418_full_validation.pdf.gz | 1 MB | 表示 | |
| XML形式データ |  emd_10418_validation.xml.gz emd_10418_validation.xml.gz | 13.5 KB | 表示 | |
| CIF形式データ |  emd_10418_validation.cif.gz emd_10418_validation.cif.gz | 19.2 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10418 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10418 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10418 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10418 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_10418.map.gz / 形式: CCP4 / 大きさ: 40.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_10418.map.gz / 形式: CCP4 / 大きさ: 40.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Postprocessed final map sharpened with a bfactor of -85A**2 and filtered to 2.96A | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.822 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_10418_msk_1.map emd_10418_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: RELION Refine3D autorefined map
| ファイル | emd_10418_additional.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | RELION Refine3D autorefined map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Refine3D half-map2
| ファイル | emd_10418_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Refine3D half-map2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Refine3D half-map1
| ファイル | emd_10418_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Refine3D half-map1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : POLYCYSTIN-2 CHANNEL TETRAMER
| 全体 | 名称: POLYCYSTIN-2 CHANNEL TETRAMER |
|---|---|
| 要素 |
|
-超分子 #1: POLYCYSTIN-2 CHANNEL TETRAMER
| 超分子 | 名称: POLYCYSTIN-2 CHANNEL TETRAMER / タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: #1 詳細: Detergent (UDM) purified in presence of lipid PI(4,5)P2 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 256 KDa |
-分子 #1: Polycystin-2
| 分子 | 名称: Polycystin-2 / タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 63.986668 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MPRVAWAERL VRGLRGLWGT RLMEESSTNR EKYLKSVLRE LVTYLLFLIV LCILTYGMMS SNVYYYTRMM SQLFLDTPVS KTEKTNFKT LSSMEDFWKF TEGSLLDGLY WKMQPSNQTE ADNRSFIFYE NLLLGVPRIR QLRVRNGSCS IPQDLRDEIK E CYDVYSVS ...文字列: MPRVAWAERL VRGLRGLWGT RLMEESSTNR EKYLKSVLRE LVTYLLFLIV LCILTYGMMS SNVYYYTRMM SQLFLDTPVS KTEKTNFKT LSSMEDFWKF TEGSLLDGLY WKMQPSNQTE ADNRSFIFYE NLLLGVPRIR QLRVRNGSCS IPQDLRDEIK E CYDVYSVS SEDRAPFGPR NGTAWIYTSE KDLNGSSHWG IIATYSGAGY YLDLSRTREE TAAQVASLKK NVWLDRGTRA TF IDFSVYN ANINLFCVVR LLVEFPATGG VIPSWQFQPL KLIRYVTTFD FFLAACEIIF CFFIFYYVVE EILEIRIHKL HYF RSFWNC LDVVIVVLSV VAIGINIYRT SNVEVLLQFL EDQNTFPNFE HLAYWQIQFN NIAAVTVFFV WIKLFKFINF NRTM SQLST TMSRCAKDLF GFAIMFFIIF LAYAQLAYLV FGTQVDDFST FQECIFTQFR IILGDINFAE IEEANRVLGP IYFTT FVFF MFFILLNMFL AIINDTYSEV KSDLAQQKAE MELSDLIRKG YHKALVKLKL KKNTVDAENL YFQ UniProtKB: Polycystin-2 |
-分子 #3: CHOLESTEROL
| 分子 | 名称: CHOLESTEROL / タイプ: ligand / ID: 3 / コピー数: 4 / 式: CLR |
|---|---|
| 分子量 | 理論値: 386.654 Da |
| Chemical component information |  ChemComp-CLR: |
-分子 #4: 2-acetamido-2-deoxy-beta-D-glucopyranose
| 分子 | 名称: 2-acetamido-2-deoxy-beta-D-glucopyranose / タイプ: ligand / ID: 4 / コピー数: 8 / 式: NAG |
|---|---|
| 分子量 | 理論値: 221.208 Da |
| Chemical component information |  ChemComp-NAG: |
-分子 #5: UNDECYL-MALTOSIDE
| 分子 | 名称: UNDECYL-MALTOSIDE / タイプ: ligand / ID: 5 / コピー数: 32 / 式: UMQ |
|---|---|
| 分子量 | 理論値: 496.589 Da |
| Chemical component information | 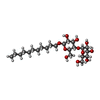 ChemComp-UMQ: |
-分子 #6: CALCIUM ION
| 分子 | 名称: CALCIUM ION / タイプ: ligand / ID: 6 / コピー数: 1 / 式: CA |
|---|---|
| 分子量 | 理論値: 40.078 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 4.5 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
| |||||||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 30 sec. / 前処理 - 雰囲気: AIR | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 278 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / デジタル化 - 画像ごとのフレーム数: 1-20 / 撮影したグリッド数: 1 / 実像数: 1597 / 平均露光時間: 8.0 sec. / 平均電子線量: 52.2 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー

















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)