+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8u7h | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of LRRK2 bound to type I inhibitor GNE-7915 | ||||||
 要素 要素 | non-specific serine/threonine protein kinase | ||||||
 キーワード キーワード | HYDROLASE/HYDROLASE INHIBITOR / Cryo-EM / Parkinson's disease / Kinase / LRRK2 / type I inhibitor / HYDROLASE / HYDROLASE-HYDROLASE INHIBITOR complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報GTP-dependent protein kinase activity / cell communication / regulation of signal transduction / protein autophosphorylation / non-specific serine/threonine protein kinase / protein phosphorylation / GTP binding / ATP binding / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.8 Å | ||||||
 データ登録者 データ登録者 | Zhu, H. / Sun, J. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: Cell Discov / 年: 2024 ジャーナル: Cell Discov / 年: 2024タイトル: Pharmacology of LRRK2 with type I and II kinase inhibitors revealed by cryo-EM. 著者: Hanwen Zhu / Patricia Hixson / Wen Ma / Ji Sun /  要旨: LRRK2 is one of the most promising drug targets for Parkinson's disease. Though type I kinase inhibitors of LRRK2 are under clinical trials, alternative strategies like type II inhibitors are being ...LRRK2 is one of the most promising drug targets for Parkinson's disease. Though type I kinase inhibitors of LRRK2 are under clinical trials, alternative strategies like type II inhibitors are being actively pursued due to the potential undesired effects of type I inhibitors. Currently, a robust method for LRRK2-inhibitor structure determination to guide structure-based drug discovery is lacking, and inhibition mechanisms of available compounds are also unclear. Here we present near-atomic-resolution structures of LRRK2 with type I (LRRK2-IN-1 and GNE-7915) and type II (rebastinib, ponatinib, and GZD-824) inhibitors, uncovering the structural basis of LRRK2 inhibition and conformational plasticity of the kinase domain with molecular dynamics (MD) simulations. Type I and II inhibitors bind to LRRK2 in active-like and inactive conformations, so LRRK2-inhibitor complexes further reveal general structural features associated with LRRK2 activation. Our study provides atomic details of LRRK2-inhibitor interactions and a framework for understanding LRRK2 activation and for rational drug design. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8u7h.cif.gz 8u7h.cif.gz | 201.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8u7h.ent.gz pdb8u7h.ent.gz | 148 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8u7h.json.gz 8u7h.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8u7h_validation.pdf.gz 8u7h_validation.pdf.gz | 1.2 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8u7h_full_validation.pdf.gz 8u7h_full_validation.pdf.gz | 1.2 MB | 表示 | |
| XML形式データ |  8u7h_validation.xml.gz 8u7h_validation.xml.gz | 40.8 KB | 表示 | |
| CIF形式データ |  8u7h_validation.cif.gz 8u7h_validation.cif.gz | 60.1 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/u7/8u7h https://data.pdbj.org/pub/pdb/validation_reports/u7/8u7h ftp://data.pdbj.org/pub/pdb/validation_reports/u7/8u7h ftp://data.pdbj.org/pub/pdb/validation_reports/u7/8u7h | HTTPS FTP |
-関連構造データ
| 関連構造データ |  41982MC  8fo7C  8u7lC  8u8aC  8u8bC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 136843.469 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: LRRK2 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: LRRK2 / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: Q17RV3 Homo sapiens (ヒト) / 参照: UniProt: Q17RV3 |
|---|---|
| #2: 化合物 | ChemComp-GDP / |
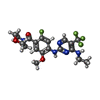
| #3: 化合物 | ChemComp-A0T / [ |
| 研究の焦点であるリガンドがあるか | Y |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: LRRK2-GNE-7915 / タイプ: COMPLEX / Entity ID: #1 / 由来: RECOMBINANT |
|---|---|
| 分子量 | 値: 137 kDa/nm / 実験値: YES |
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 由来(組換発現) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 緩衝液 | pH: 7.5 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: OTHER FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: OTHER |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2400 nm / 最小 デフォーカス(公称値): 800 nm |
| 撮影 | 電子線照射量: 62.08 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) |
- 解析
解析
| EMソフトウェア |
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: NONE | ||||||||||||
| 対称性 | 点対称性: C1 (非対称) | ||||||||||||
| 3次元再構成 | 解像度: 3.8 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 95644 / 対称性のタイプ: POINT |
 ムービー
ムービー コントローラー
コントローラー







 PDBj
PDBj