+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7tap | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of archazolid A bound to yeast VO V-ATPase | ||||||||||||||||||||||||||||||||||||
 要素 要素 |
| ||||||||||||||||||||||||||||||||||||
 キーワード キーワード | MEMBRANE PROTEIN / inhibitor / complex / proton pump / ATPase | ||||||||||||||||||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cell wall mannoprotein biosynthetic process / ATPase-coupled ion transmembrane transporter activity / protein localization to vacuolar membrane / cellular response to alkaline pH / polyphosphate metabolic process / Insulin receptor recycling / Transferrin endocytosis and recycling / ROS and RNS production in phagocytes / Amino acids regulate mTORC1 / Golgi lumen acidification ...cell wall mannoprotein biosynthetic process / ATPase-coupled ion transmembrane transporter activity / protein localization to vacuolar membrane / cellular response to alkaline pH / polyphosphate metabolic process / Insulin receptor recycling / Transferrin endocytosis and recycling / ROS and RNS production in phagocytes / Amino acids regulate mTORC1 / Golgi lumen acidification / P-type proton-exporting transporter activity / vacuolar transport / vacuolar proton-transporting V-type ATPase, V0 domain / endosomal lumen acidification / vacuole organization / protein targeting to vacuole / proton-transporting V-type ATPase complex / vacuolar proton-transporting V-type ATPase complex / fungal-type vacuole / cellular hyperosmotic response / vacuolar acidification / fungal-type vacuole membrane / phosphatidylinositol-3,5-bisphosphate binding / proton transmembrane transporter activity / intracellular copper ion homeostasis / proton-transporting ATPase activity, rotational mechanism / Neutrophil degranulation / RNA endonuclease activity / proton transmembrane transport / cell periphery / transmembrane transport / endocytosis / ATPase binding / protein-containing complex assembly / intracellular iron ion homeostasis / membrane raft / Golgi membrane / endoplasmic reticulum membrane / membrane 類似検索 - 分子機能 | ||||||||||||||||||||||||||||||||||||
| 生物種 |  | ||||||||||||||||||||||||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.8 Å | ||||||||||||||||||||||||||||||||||||
 データ登録者 データ登録者 | Keon, K.A. / Rubinstein, J.L. / Benlekbir, S. / Kirsch, S.H. / Muller, R. | ||||||||||||||||||||||||||||||||||||
| 資金援助 |  カナダ, 1件 カナダ, 1件
| ||||||||||||||||||||||||||||||||||||
 引用 引用 |  ジャーナル: ACS Chem Biol / 年: 2022 ジャーナル: ACS Chem Biol / 年: 2022タイトル: Cryo-EM of the Yeast V Complex Reveals Distinct Binding Sites for Macrolide V-ATPase Inhibitors. 著者: Kristine A Keon / Samir Benlekbir / Susanne H Kirsch / Rolf Müller / John L Rubinstein /   要旨: Vacuolar-type adenosine triphosphatases (V-ATPases) are proton pumps found in almost all eukaryotic cells. These enzymes consist of a soluble catalytic V region that hydrolyzes ATP and a membrane- ...Vacuolar-type adenosine triphosphatases (V-ATPases) are proton pumps found in almost all eukaryotic cells. These enzymes consist of a soluble catalytic V region that hydrolyzes ATP and a membrane-embedded V region responsible for proton translocation. V-ATPase activity leads to acidification of endosomes, phagosomes, lysosomes, secretory vesicles, and the trans-Golgi network, with extracellular acidification occurring in some specialized cells. Small-molecule inhibitors of V-ATPase have played a crucial role in elucidating numerous aspects of cell biology by blocking acidification of intracellular compartments, while therapeutic use of V-ATPase inhibitors has been proposed for the treatment of cancer, osteoporosis, and some infections. Here, we determine structures of the isolated V complex from bound to two well-known macrolide inhibitors: bafilomycin A1 and archazolid A. The structures reveal different binding sites for the inhibitors on the surface of the proton-carrying c ring, with only a small amount of overlap between the two sites. Binding of both inhibitors is mediated primarily through van der Waals interactions in shallow pockets and suggests that the inhibitors block rotation of the ring. Together, these structures indicate the existence of a large chemical space available for V-ATPase inhibitors that block acidification by binding the c ring. | ||||||||||||||||||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7tap.cif.gz 7tap.cif.gz | 493.6 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7tap.ent.gz pdb7tap.ent.gz | 405.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7tap.json.gz 7tap.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7tap_validation.pdf.gz 7tap_validation.pdf.gz | 1.4 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7tap_full_validation.pdf.gz 7tap_full_validation.pdf.gz | 1.5 MB | 表示 | |
| XML形式データ |  7tap_validation.xml.gz 7tap_validation.xml.gz | 93.2 KB | 表示 | |
| CIF形式データ |  7tap_validation.cif.gz 7tap_validation.cif.gz | 134.6 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ta/7tap https://data.pdbj.org/pub/pdb/validation_reports/ta/7tap ftp://data.pdbj.org/pub/pdb/validation_reports/ta/7tap ftp://data.pdbj.org/pub/pdb/validation_reports/ta/7tap | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-V-type proton ATPase subunit ... , 6種, 13分子 DCMEFGHIJKLBA
| #1: タンパク質 | 分子量: 17046.361 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  | ||||
|---|---|---|---|---|---|
| #2: タンパク質 | 分子量: 22610.641 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  | ||||
| #4: タンパク質 | 分子量: 8387.065 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  | ||||
| #5: タンパク質 | 分子量: 16357.501 Da / 分子数: 8 / 由来タイプ: 天然 / 由来: (天然)  #7: タンパク質 | | 分子量: 39822.484 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  #8: タンパク質 | | 分子量: 95625.484 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
-タンパク質 , 2種, 2分子 NO
| #3: タンパク質 | 分子量: 29694.885 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
|---|---|
| #6: タンパク質 | 分子量: 9369.934 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
-非ポリマー , 1種, 8分子 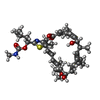
| #9: 化合物 | ChemComp-KJL / |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|---|
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Cryo-EM structure of archazolid A bound to yeast VO V-ATPase タイプ: COMPLEX / Entity ID: #1-#8 / 由来: NATURAL |
|---|---|
| 由来(天然) | 生物種:  |
| 緩衝液 | pH: 7.4 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2550 nm / 最小 デフォーカス(公称値): 370 nm |
| 撮影 | 電子線照射量: 42 e/Å2 フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 詳細: Prototype Falcon 4i camera |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.19_4092: / 分類: 精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア | 名称: PHENIX / カテゴリ: モデル精密化 | ||||||||||||||||||||||||
| CTF補正 | タイプ: NONE | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 2.8 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 659182 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj












