+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7d77 | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the cortisol-bound adhesion receptor GPR97-Go complex | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | MEMBRANE PROTEIN / GPCR / GPR97 / complex / adhesion G protein-coupled receptor | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報negative regulation of CREB transcription factor activity / vesicle docking involved in exocytosis / negative regulation of non-canonical NF-kappaB signal transduction / G protein-coupled dopamine receptor signaling pathway / regulation of heart contraction / mu-type opioid receptor binding / corticotropin-releasing hormone receptor 1 binding / negative regulation of insulin secretion / G protein-coupled serotonin receptor binding / specific granule membrane ...negative regulation of CREB transcription factor activity / vesicle docking involved in exocytosis / negative regulation of non-canonical NF-kappaB signal transduction / G protein-coupled dopamine receptor signaling pathway / regulation of heart contraction / mu-type opioid receptor binding / corticotropin-releasing hormone receptor 1 binding / negative regulation of insulin secretion / G protein-coupled serotonin receptor binding / specific granule membrane / regulation of cell migration / B cell differentiation / locomotory behavior / muscle contraction / G protein-coupled receptor activity / G-protein beta/gamma-subunit complex binding / Olfactory Signaling Pathway / Activation of the phototransduction cascade / adenylate cyclase-modulating G protein-coupled receptor signaling pathway / G beta:gamma signalling through PLC beta / Presynaptic function of Kainate receptors / Thromboxane signalling through TP receptor / G-protein activation / adenylate cyclase-activating G protein-coupled receptor signaling pathway / G protein-coupled acetylcholine receptor signaling pathway / Activation of G protein gated Potassium channels / Inhibition of voltage gated Ca2+ channels via Gbeta/gamma subunits / Prostacyclin signalling through prostacyclin receptor / Glucagon signaling in metabolic regulation / G beta:gamma signalling through CDC42 / ADP signalling through P2Y purinoceptor 12 / G beta:gamma signalling through BTK / Synthesis, secretion, and inactivation of Glucagon-like Peptide-1 (GLP-1) / Sensory perception of sweet, bitter, and umami (glutamate) taste / photoreceptor disc membrane / Adrenaline,noradrenaline inhibits insulin secretion / Glucagon-type ligand receptors / Vasopressin regulates renal water homeostasis via Aquaporins / G alpha (z) signalling events / cellular response to catecholamine stimulus / Glucagon-like Peptide-1 (GLP1) regulates insulin secretion / ADORA2B mediated anti-inflammatory cytokines production / sensory perception of taste / ADP signalling through P2Y purinoceptor 1 / adenylate cyclase-activating dopamine receptor signaling pathway / G beta:gamma signalling through PI3Kgamma / cellular response to prostaglandin E stimulus / Cooperation of PDCL (PhLP1) and TRiC/CCT in G-protein beta folding / GPER1 signaling / G-protein beta-subunit binding / Inactivation, recovery and regulation of the phototransduction cascade / heterotrimeric G-protein complex / G alpha (12/13) signalling events / extracellular vesicle / signaling receptor complex adaptor activity / Thrombin signalling through proteinase activated receptors (PARs) / GTPase binding / retina development in camera-type eye / phospholipase C-activating G protein-coupled receptor signaling pathway / Ca2+ pathway / heparin binding / G alpha (i) signalling events / cell body / fibroblast proliferation / G alpha (s) signalling events / G alpha (q) signalling events / cell population proliferation / Ras protein signal transduction / Extra-nuclear estrogen signaling / cell surface receptor signaling pathway / G protein-coupled receptor signaling pathway / lysosomal membrane / GTPase activity / synapse / dendrite / Neutrophil degranulation / protein-containing complex binding / GTP binding / signal transduction / extracellular exosome / membrane / metal ion binding / plasma membrane / cytoplasm / cytosol 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト)synthetic construct (人工物) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.9 Å | ||||||
 データ登録者 データ登録者 | Ping, Y. / Mao, C. / Xiao, P. / Zhao, R. / Jiang, Y. / Yang, Z. / An, W. / Shen, D. / Yang, F. / Zhang, H. ...Ping, Y. / Mao, C. / Xiao, P. / Zhao, R. / Jiang, Y. / Yang, Z. / An, W. / Shen, D. / Yang, F. / Zhang, H. / Qu, C. / Shen, Q. / Tian, C. / Li, Z. / Li, S. / Wang, G. / Tao, X. / Wen, X. / Zhong, Y. / Yang, J. / Yi, F. / Yu, X. / Xu, E. / Zhang, Y. / Sun, J. | ||||||
 引用 引用 |  ジャーナル: Nature / 年: 2021 ジャーナル: Nature / 年: 2021タイトル: Structures of the glucocorticoid-bound adhesion receptor GPR97-G complex. 著者: Yu-Qi Ping / Chunyou Mao / Peng Xiao / Ru-Jia Zhao / Yi Jiang / Zhao Yang / Wen-Tao An / Dan-Dan Shen / Fan Yang / Huibing Zhang / Changxiu Qu / Qingya Shen / Caiping Tian / Zi-Jian Li / ...著者: Yu-Qi Ping / Chunyou Mao / Peng Xiao / Ru-Jia Zhao / Yi Jiang / Zhao Yang / Wen-Tao An / Dan-Dan Shen / Fan Yang / Huibing Zhang / Changxiu Qu / Qingya Shen / Caiping Tian / Zi-Jian Li / Shaolong Li / Guang-Yu Wang / Xiaona Tao / Xin Wen / Ya-Ni Zhong / Jing Yang / Fan Yi / Xiao Yu / H Eric Xu / Yan Zhang / Jin-Peng Sun /  要旨: Adhesion G-protein-coupled receptors (GPCRs) are a major family of GPCRs, but limited knowledge of their ligand regulation or structure is available. Here we report that glucocorticoid stress ...Adhesion G-protein-coupled receptors (GPCRs) are a major family of GPCRs, but limited knowledge of their ligand regulation or structure is available. Here we report that glucocorticoid stress hormones activate adhesion G-protein-coupled receptor G3 (ADGRG3; also known as GPR97), a prototypical adhesion GPCR. The cryo-electron microscopy structures of GPR97-G complexes bound to the anti-inflammatory drug beclomethasone or the steroid hormone cortisol revealed that glucocorticoids bind to a pocket within the transmembrane domain. The steroidal core of glucocorticoids is packed against the 'toggle switch' residue W, which senses the binding of a ligand and induces activation of the receptor. Active GPR97 uses a quaternary core and HLY motif to fasten the seven-transmembrane bundle and to mediate G protein coupling. The cytoplasmic side of GPR97 has an open cavity, where all three intracellular loops interact with the G protein, contributing to the high basal activity of GRP97. Palmitoylation at the cytosolic tail of the G protein was found to be essential for efficient engagement with GPR97 but is not observed in other solved GPCR complex structures. Our work provides a structural basis for ligand binding to the seven-transmembrane domain of an adhesion GPCR and subsequent G protein coupling. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7d77.cif.gz 7d77.cif.gz | 210.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7d77.ent.gz pdb7d77.ent.gz | 167.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7d77.json.gz 7d77.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7d77_validation.pdf.gz 7d77_validation.pdf.gz | 1.1 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7d77_full_validation.pdf.gz 7d77_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  7d77_validation.xml.gz 7d77_validation.xml.gz | 40.6 KB | 表示 | |
| CIF形式データ |  7d77_validation.cif.gz 7d77_validation.cif.gz | 60.7 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/d7/7d77 https://data.pdbj.org/pub/pdb/validation_reports/d7/7d77 ftp://data.pdbj.org/pub/pdb/validation_reports/d7/7d77 ftp://data.pdbj.org/pub/pdb/validation_reports/d7/7d77 | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-Guanine nucleotide-binding protein ... , 3種, 3分子 ABG
| #1: タンパク質 | 分子量: 25286.922 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GNAO1 / Cell (発現宿主): sf9 Homo sapiens (ヒト) / 遺伝子: GNAO1 / Cell (発現宿主): sf9発現宿主:  参照: UniProt: P09471*PLUS |
|---|---|
| #2: タンパク質 | 分子量: 38245.801 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GNB1 / Cell (発現宿主): sf9 Homo sapiens (ヒト) / 遺伝子: GNB1 / Cell (発現宿主): sf9発現宿主:  参照: UniProt: P62873 |
| #3: タンパク質 | 分子量: 7861.143 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GNG2 / Cell (発現宿主): sf9 Homo sapiens (ヒト) / 遺伝子: GNG2 / Cell (発現宿主): sf9発現宿主:  参照: UniProt: P59768 |
-タンパク質 / 抗体 , 2種, 2分子 RS
| #4: タンパク質 | 分子量: 62767.098 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: ADGRG3 / Cell (発現宿主): sf9 Homo sapiens (ヒト) / 遺伝子: ADGRG3 / Cell (発現宿主): sf9発現宿主:  参照: UniProt: Q86Y34*PLUS |
|---|---|
| #5: 抗体 | 分子量: 26610.615 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現) synthetic construct (人工物) / Cell (発現宿主): sf9 発現宿主:  |
-非ポリマー , 5種, 8分子 
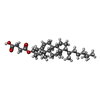







| #6: 化合物 | | #7: 化合物 | ChemComp-Y01 / | #8: 化合物 | ChemComp-HCY / ( | #9: 化合物 | #10: 水 | ChemComp-HOH / | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 |
| ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 由来(天然) |
| ||||||||||||||||||||||||||||||
| 由来(組換発現) |
| ||||||||||||||||||||||||||||||
| 緩衝液 | pH: 7.5 | ||||||||||||||||||||||||||||||
| 試料 | 濃度: 20 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | ||||||||||||||||||||||||||||||
| 試料支持 | グリッドの材料: GOLD / グリッドのタイプ: Quantifoil | ||||||||||||||||||||||||||||||
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 29000 X / 倍率(補正後): 49310 X / Cs: 2.7 mm |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 電子線照射量: 62 e/Å2 / 検出モード: COUNTING フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 実像数: 5871 |
| 画像スキャン | 動画フレーム数/画像: 40 |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.16_3549: / 分類: 精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 4323518 | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 2.9 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 75814 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 原子モデル構築 | PDB-ID: 6G79 | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー

















 PDBj
PDBj































