+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-9685 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of Echovirus 6 complexed with its attachment receptor CD55 at PH 7.4 | |||||||||
 マップデータ マップデータ | Cryo-EM structure of Echovirus 6 complexed with its attachment receptor CD55 at PH 7.4 | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Echovirus 6 / CD55 / Cryo-EM / virus-receptor complex / VIRUS | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of lipopolysaccharide-mediated signaling pathway / negative regulation of complement activation / regulation of complement-dependent cytotoxicity / regulation of complement activation / respiratory burst / positive regulation of CD4-positive, alpha-beta T cell activation / positive regulation of CD4-positive, alpha-beta T cell proliferation / Class B/2 (Secretin family receptors) / ficolin-1-rich granule membrane / complement activation, classical pathway ...regulation of lipopolysaccharide-mediated signaling pathway / negative regulation of complement activation / regulation of complement-dependent cytotoxicity / regulation of complement activation / respiratory burst / positive regulation of CD4-positive, alpha-beta T cell activation / positive regulation of CD4-positive, alpha-beta T cell proliferation / Class B/2 (Secretin family receptors) / ficolin-1-rich granule membrane / complement activation, classical pathway / transport vesicle / side of membrane / COPI-mediated anterograde transport / endoplasmic reticulum-Golgi intermediate compartment membrane / secretory granule membrane / Regulation of Complement cascade / positive regulation of T cell cytokine production / positive regulation of cytosolic calcium ion concentration / virus receptor activity / membrane raft / Golgi membrane / innate immune response / lipid binding / Neutrophil degranulation / cell surface / extracellular exosome / extracellular region / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Echovirus E6 (ウイルス) / Echovirus E6 (ウイルス) /  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.0 Å | |||||||||
 データ登録者 データ登録者 | Gao GF / Liu S | |||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Cell / 年: 2019 ジャーナル: Cell / 年: 2019タイトル: Human Neonatal Fc Receptor Is the Cellular Uncoating Receptor for Enterovirus B. 著者: Xin Zhao / Guigen Zhang / Sheng Liu / Xiangpeng Chen / Ruchao Peng / Lianpan Dai / Xiao Qu / Shihua Li / Hao Song / Zhengrong Gao / Pengfei Yuan / Zhiheng Liu / Changyao Li / Zifang Shang / ...著者: Xin Zhao / Guigen Zhang / Sheng Liu / Xiangpeng Chen / Ruchao Peng / Lianpan Dai / Xiao Qu / Shihua Li / Hao Song / Zhengrong Gao / Pengfei Yuan / Zhiheng Liu / Changyao Li / Zifang Shang / Yan Li / Meifan Zhang / Jianxun Qi / Han Wang / Ning Du / Yan Wu / Yuhai Bi / Shan Gao / Yi Shi / Jinghua Yan / Yong Zhang / Zhengde Xie / Wensheng Wei / George F Gao /  要旨: Enterovirus B (EV-B), a major proportion of the genus Enterovirus in the family Picornaviridae, is the causative agent of severe human infectious diseases. Although cellular receptors for ...Enterovirus B (EV-B), a major proportion of the genus Enterovirus in the family Picornaviridae, is the causative agent of severe human infectious diseases. Although cellular receptors for coxsackievirus B in EV-B have been identified, receptors mediating virus entry, especially the uncoating process of echovirus and other EV-B remain obscure. Here, we found that human neonatal Fc receptor (FcRn) is the uncoating receptor for major EV-B. FcRn binds to the virus particles in the "canyon" through its FCGRT subunit. By obtaining multiple cryo-electron microscopy structures at different stages of virus entry at atomic or near-atomic resolution, we deciphered the underlying mechanisms of enterovirus attachment and uncoating. These structures revealed that different from the attachment receptor CD55, binding of FcRn to the virions induces efficient release of "pocket factor" under acidic conditions and initiates the conformational changes in viral particle, providing a structural basis for understanding the mechanisms of enterovirus entry. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_9685.map.gz emd_9685.map.gz | 41.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-9685-v30.xml emd-9685-v30.xml emd-9685.xml emd-9685.xml | 20.5 KB 20.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_9685_fsc.xml emd_9685_fsc.xml | 14 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_9685.png emd_9685.png | 204.2 KB | ||
| Filedesc metadata |  emd-9685.cif.gz emd-9685.cif.gz | 7.5 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-9685 http://ftp.pdbj.org/pub/emdb/structures/EMD-9685 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-9685 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-9685 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_9685_validation.pdf.gz emd_9685_validation.pdf.gz | 543.7 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_9685_full_validation.pdf.gz emd_9685_full_validation.pdf.gz | 543.2 KB | 表示 | |
| XML形式データ |  emd_9685_validation.xml.gz emd_9685_validation.xml.gz | 13.4 KB | 表示 | |
| CIF形式データ |  emd_9685_validation.cif.gz emd_9685_validation.cif.gz | 18.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9685 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9685 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9685 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-9685 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6ilkMC  9684C  9686C  9687C  9688C  9689C  9690C  6iljC  6illC  6ilmC  6ilnC  6iloC  6ilpC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_9685.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_9685.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM structure of Echovirus 6 complexed with its attachment receptor CD55 at PH 7.4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.35 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Cryo-EM structure of Echovirus 6 complexed with its attachment re...
| 全体 | 名称: Cryo-EM structure of Echovirus 6 complexed with its attachment receptor CD55 at PH 7.4 |
|---|---|
| 要素 |
|
-超分子 #1: Cryo-EM structure of Echovirus 6 complexed with its attachment re...
| 超分子 | 名称: Cryo-EM structure of Echovirus 6 complexed with its attachment receptor CD55 at PH 7.4 タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#5 |
|---|---|
| 由来(天然) | 生物種:  Echovirus E6 (ウイルス) Echovirus E6 (ウイルス) |
-分子 #1: Capsid protein VP1
| 分子 | 名称: Capsid protein VP1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Echovirus E6 (ウイルス) Echovirus E6 (ウイルス) |
| 分子量 | 理論値: 31.707332 KDa |
| 配列 | 文字列: VVRVADTMPS GPSNSESIPA LTAAETGHTS QVVPSDTIQT RHVRNFHVRS ESSVENFLSR SACVYIVEYK TRDDTPDKMY DSWVINTRQ VAQLRRKLEF FTYVRFDVEV TFVITSVQDD STRQNTDTPA LTHQIMYVPP GGPIPQAVDD YNWQTSTNPS V FWTEGNAP ...文字列: VVRVADTMPS GPSNSESIPA LTAAETGHTS QVVPSDTIQT RHVRNFHVRS ESSVENFLSR SACVYIVEYK TRDDTPDKMY DSWVINTRQ VAQLRRKLEF FTYVRFDVEV TFVITSVQDD STRQNTDTPA LTHQIMYVPP GGPIPQAVDD YNWQTSTNPS V FWTEGNAP PRMSIPFMSV GNAYSNFYDG WSHFSQTGVY GFNTLNNMGK LYFRHVNDKT ISPITSKVRI YFKPKHVKAW VP RPPRLCE YTHKDNVDFE PKGVTTSRTQ LTISNSTHVE N |
-分子 #2: Capsid protein VP2
| 分子 | 名称: Capsid protein VP2 / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Echovirus E6 (ウイルス) Echovirus E6 (ウイルス) |
| 分子量 | 理論値: 28.06452 KDa |
| 配列 | 文字列: SDRVRSITLG NSTITTQESA NVVVGYGVWP DYLSDEEATA EDQPTQPDVA TCRFYTLDSV SWMKESQGWW WKFPDALRDM GLFGQNMQY HYLGRSGYTI HVQCNASKFH QGCLLVVCVP EAEMGAANIN EKINREHLSN GEVANTFSGT KSSNTNDVQQ A VFNAGMGV ...文字列: SDRVRSITLG NSTITTQESA NVVVGYGVWP DYLSDEEATA EDQPTQPDVA TCRFYTLDSV SWMKESQGWW WKFPDALRDM GLFGQNMQY HYLGRSGYTI HVQCNASKFH QGCLLVVCVP EAEMGAANIN EKINREHLSN GEVANTFSGT KSSNTNDVQQ A VFNAGMGV AVGNLTIFPH QWINLRTNNC ATIVMPYINS VPMDNMFRHY NFTLMIIPFA KLDYAAGSST YIPITVTVAP MC AEYNGLR LAGHQ |
-分子 #3: Capsid protein VP3
| 分子 | 名称: Capsid protein VP3 / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Echovirus E6 (ウイルス) Echovirus E6 (ウイルス) |
| 分子量 | 理論値: 26.378936 KDa |
| 配列 | 文字列: GLPVMNTPGS NQFLTSDDYQ SPTAMPQFDV TPEMNIPGEV KNLMEIAEVD SVVPVNNVNE NVNSLEAYRI PVHSVTETGA QVFGFTLQP GADTVMERTL LGEILNYYAN WSGSIKLTFM YCGSAMATGK FLLAYSPPGA GVPKNRREAM LGTHIIWDIG L QSSCVLCV ...文字列: GLPVMNTPGS NQFLTSDDYQ SPTAMPQFDV TPEMNIPGEV KNLMEIAEVD SVVPVNNVNE NVNSLEAYRI PVHSVTETGA QVFGFTLQP GADTVMERTL LGEILNYYAN WSGSIKLTFM YCGSAMATGK FLLAYSPPGA GVPKNRREAM LGTHIIWDIG L QSSCVLCV PWISQTHYRF VSKDIYTDAG FITCWYQTSI VVPAEVQNQS VILCFVSACN DFSVRLLRDS PFVRQTAFYQ |
-分子 #4: Capsid protein VP4
| 分子 | 名称: Capsid protein VP4 / タイプ: protein_or_peptide / ID: 4 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Echovirus E6 (ウイルス) Echovirus E6 (ウイルス) |
| 分子量 | 理論値: 7.338014 KDa |
| 配列 | 文字列: GAQVSTQKTG AHETSLSASG NSIIHYTNIN YYKDAASNSA NRQDFTQDPG KFTEPVKDIM VKSLPALN |
-分子 #5: Complement decay-accelerating factor
| 分子 | 名称: Complement decay-accelerating factor / タイプ: protein_or_peptide / ID: 5 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 21.307959 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: CNRSCEVPTR LNSASLKQPY ITQNYFPVGT VVEYECRPGY RREPSLSPKL TCLQNLKWST AVEFCKKKSC PNPGEIRNGQ IDVPGGILF GATISFSCNT GYKLFGSTSS FCLISGSSVQ WSDPLPECRE IYCPAPPQID NGIIQGERDH YGYRQSVTYA C NKGFTMIG ...文字列: CNRSCEVPTR LNSASLKQPY ITQNYFPVGT VVEYECRPGY RREPSLSPKL TCLQNLKWST AVEFCKKKSC PNPGEIRNGQ IDVPGGILF GATISFSCNT GYKLFGSTSS FCLISGSSVQ WSDPLPECRE IYCPAPPQID NGIIQGERDH YGYRQSVTYA C NKGFTMIG EHSIYCTVNN DEGEWSGPPP ECRG UniProtKB: Complement decay-accelerating factor |
-分子 #6: SPHINGOSINE
| 分子 | 名称: SPHINGOSINE / タイプ: ligand / ID: 6 / コピー数: 1 / 式: SPH |
|---|---|
| 分子量 | 理論値: 299.492 Da |
| Chemical component information | 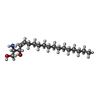 ChemComp-SPH: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) 検出モード: SUPER-RESOLUTION / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT |
|---|---|
| 得られたモデル |  PDB-6ilk: |
 ムービー
ムービー コントローラー
コントローラー

















