+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-30887 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of amyloid fibril formed by familial prion disease-related mutation E196K | |||||||||
 マップデータ マップデータ | Masked density map | |||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of glutamate receptor signaling pathway / negative regulation of amyloid precursor protein catabolic process / lamin binding / regulation of glutamate receptor signaling pathway / regulation of calcium ion import across plasma membrane / aspartic-type endopeptidase inhibitor activity / glycosaminoglycan binding / ATP-dependent protein binding / regulation of potassium ion transmembrane transport / negative regulation of interleukin-17 production ...positive regulation of glutamate receptor signaling pathway / negative regulation of amyloid precursor protein catabolic process / lamin binding / regulation of glutamate receptor signaling pathway / regulation of calcium ion import across plasma membrane / aspartic-type endopeptidase inhibitor activity / glycosaminoglycan binding / ATP-dependent protein binding / regulation of potassium ion transmembrane transport / negative regulation of interleukin-17 production / NCAM1 interactions / negative regulation of dendritic spine maintenance / type 5 metabotropic glutamate receptor binding / cupric ion binding / negative regulation of protein processing / negative regulation of calcineurin-NFAT signaling cascade / dendritic spine maintenance / negative regulation of interleukin-2 production / negative regulation of T cell receptor signaling pathway / Insertion of tail-anchored proteins into the endoplasmic reticulum membrane / extrinsic component of membrane / cuprous ion binding / negative regulation of amyloid-beta formation / negative regulation of activated T cell proliferation / response to amyloid-beta / : / negative regulation of type II interferon production / negative regulation of long-term synaptic potentiation / intracellular copper ion homeostasis / positive regulation of protein targeting to membrane / long-term memory / response to cadmium ion / regulation of peptidyl-tyrosine phosphorylation / inclusion body / cellular response to copper ion / neuron projection maintenance / tubulin binding / negative regulation of protein phosphorylation / molecular condensate scaffold activity / molecular function activator activity / positive regulation of protein localization to plasma membrane / protein destabilization / protein homooligomerization / negative regulation of DNA-binding transcription factor activity / terminal bouton / cellular response to amyloid-beta / positive regulation of peptidyl-tyrosine phosphorylation / positive regulation of neuron apoptotic process / cellular response to xenobiotic stimulus / signaling receptor activity / amyloid-beta binding / protein-folding chaperone binding / postsynapse / microtubule binding / nuclear membrane / protease binding / response to oxidative stress / transmembrane transporter binding / molecular adaptor activity / postsynaptic density / learning or memory / regulation of cell cycle / cell cycle / membrane raft / copper ion binding / external side of plasma membrane / intracellular membrane-bounded organelle / dendrite / protein-containing complex binding / negative regulation of apoptotic process / Golgi apparatus / cell surface / endoplasmic reticulum / extracellular exosome / identical protein binding / plasma membrane / cytoplasm / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 3.07 Å | |||||||||
 データ登録者 データ登録者 | Wang LQ / Zhao K / Yuan HY / Li XN / Dang HB / Ma YY / Wang Q / Wang C / Sun YP / Chen J ...Wang LQ / Zhao K / Yuan HY / Li XN / Dang HB / Ma YY / Wang Q / Wang C / Sun YP / Chen J / Li D / Zhang DL / Yin P / Liu C / Liang Y | |||||||||
 引用 引用 |  ジャーナル: Sci Adv / 年: 2021 ジャーナル: Sci Adv / 年: 2021タイトル: Genetic prion disease-related mutation E196K displays a novel amyloid fibril structure revealed by cryo-EM. 著者: Li-Qiang Wang / Kun Zhao / Han-Ye Yuan / Xiang-Ning Li / Hai-Bin Dang / Yeyang Ma / Qiang Wang / Chen Wang / Yunpeng Sun / Jie Chen / Dan Li / Delin Zhang / Ping Yin / Cong Liu / Yi Liang /  要旨: Prion diseases are caused by the conformational conversion of prion protein (PrP). Forty-two different mutations were identified in human PrP, leading to genetic prion diseases with distinct clinical ...Prion diseases are caused by the conformational conversion of prion protein (PrP). Forty-two different mutations were identified in human PrP, leading to genetic prion diseases with distinct clinical syndromes. Here, we report the cryo–electron microscopy structure of an amyloid fibril formed by full-length human PrP with E196K mutation, a genetic Creutzfeldt-Jakob disease–related mutation. This mutation disrupts key interactions in the wild-type PrP fibril, forming an amyloid fibril with a conformation distinct from the wild-type PrP fibril and hamster brain–derived prion fibril. The E196K fibril consists of two protofibrils. Each subunit forms five β strands stabilized by a disulfide bond and an unusual hydrophilic cavity stabilized by a salt bridge. Four pairs of amino acids from opposing subunits form four salt bridges to stabilize the zigzag interface of the two protofibrils. Our results provide structural evidences of the diverse prion strains and highlight the importance of familial mutations in inducing different strains. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_30887.map.gz emd_30887.map.gz | 15.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-30887-v30.xml emd-30887-v30.xml emd-30887.xml emd-30887.xml | 12.5 KB 12.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_30887_fsc.xml emd_30887_fsc.xml | 14.2 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_30887.png emd_30887.png | 28.1 KB | ||
| マスクデータ |  emd_30887_msk_1.map emd_30887_msk_1.map | 244.1 MB |  マスクマップ マスクマップ | |
| その他 |  emd_30887_additional_1.map.gz emd_30887_additional_1.map.gz | 228.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-30887 http://ftp.pdbj.org/pub/emdb/structures/EMD-30887 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-30887 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-30887 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_30887_validation.pdf.gz emd_30887_validation.pdf.gz | 384 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_30887_full_validation.pdf.gz emd_30887_full_validation.pdf.gz | 383.5 KB | 表示 | |
| XML形式データ |  emd_30887_validation.xml.gz emd_30887_validation.xml.gz | 14.1 KB | 表示 | |
| CIF形式データ |  emd_30887_validation.cif.gz emd_30887_validation.cif.gz | 19 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-30887 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-30887 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-30887 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-30887 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_30887.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_30887.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Masked density map | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.014 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_30887_msk_1.map emd_30887_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
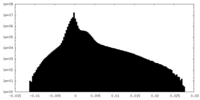
| 密度ヒストグラム |
-追加マップ: Unmasked density map
| ファイル | emd_30887_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unmasked density map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human prion E196K mutation amyloid fibril
| 全体 | 名称: Human prion E196K mutation amyloid fibril |
|---|---|
| 要素 |
|
-超分子 #1: Human prion E196K mutation amyloid fibril
| 超分子 | 名称: Human prion E196K mutation amyloid fibril / タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
-分子 #1: Major prion protein
| 分子 | 名称: Major prion protein / タイプ: protein_or_peptide / ID: 1 / コピー数: 6 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 22.996422 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MKKRPKPGGW NTGGSRYPGQ GSPGGNRYPP QGGGGWGQPH GGGWGQPHGG GWGQPHGGGW GQPHGGGWGQ GGGTHSQWNK PSKPKTNMK HMAGAAAAGA VVGGLGGYML GSAMSRPIIH FGSDYEDRYY RENMHRYPNQ VYYRPMDEYS NQNNFVHDCV N ITIKQHTV ...文字列: MKKRPKPGGW NTGGSRYPGQ GSPGGNRYPP QGGGGWGQPH GGGWGQPHGG GWGQPHGGGW GQPHGGGWGQ GGGTHSQWNK PSKPKTNMK HMAGAAAAGA VVGGLGGYML GSAMSRPIIH FGSDYEDRYY RENMHRYPNQ VYYRPMDEYS NQNNFVHDCV N ITIKQHTV TTTTKGKNFT ETDVKMMERV VEQMCITQYE RESQAYYQRG SS |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | helical array |
- 試料調製
試料調製
| 緩衝液 | pH: 5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 64.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー













 Z
Z Y
Y X
X