+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7pg0 | ||||||
|---|---|---|---|---|---|---|---|
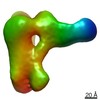
| タイトル | Low resolution Cryo-EM structure of full-length insulin receptor bound to 3 insulin with visible ddm micelle, conf 1 | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | MEMBRANE PROTEIN / Insulin / Receptor / Complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of female gonad development / positive regulation of meiotic cell cycle / positive regulation of developmental growth / insulin-like growth factor II binding / male sex determination / exocrine pancreas development / insulin receptor complex / insulin-like growth factor I binding / insulin receptor activity / positive regulation of protein-containing complex disassembly ...regulation of female gonad development / positive regulation of meiotic cell cycle / positive regulation of developmental growth / insulin-like growth factor II binding / male sex determination / exocrine pancreas development / insulin receptor complex / insulin-like growth factor I binding / insulin receptor activity / positive regulation of protein-containing complex disassembly / cargo receptor activity / dendritic spine maintenance / insulin binding / PTB domain binding / negative regulation of NAD(P)H oxidase activity / negative regulation of glycogen catabolic process / regulation of cellular amino acid metabolic process / adrenal gland development / positive regulation of nitric oxide mediated signal transduction / negative regulation of fatty acid metabolic process / negative regulation of feeding behavior / neuronal cell body membrane / Signaling by Insulin receptor / IRS activation / activation of protein kinase activity / Insulin processing / regulation of protein secretion / amyloid-beta clearance / positive regulation of respiratory burst / positive regulation of peptide hormone secretion / Regulation of gene expression in beta cells / negative regulation of acute inflammatory response / positive regulation of receptor internalization / alpha-beta T cell activation / regulation of embryonic development / negative regulation of respiratory burst involved in inflammatory response / transport across blood-brain barrier / insulin receptor substrate binding / positive regulation of dendritic spine maintenance / positive regulation of glycogen biosynthetic process / Synthesis, secretion, and deacylation of Ghrelin / epidermis development / negative regulation of protein secretion / regulation of protein localization to plasma membrane / fatty acid homeostasis / Signal attenuation / negative regulation of lipid catabolic process / FOXO-mediated transcription of oxidative stress, metabolic and neuronal genes / negative regulation of gluconeogenesis / phosphatidylinositol 3-kinase binding / COPI-mediated anterograde transport / positive regulation of lipid biosynthetic process / heart morphogenesis / negative regulation of oxidative stress-induced intrinsic apoptotic signaling pathway / negative regulation of reactive oxygen species biosynthetic process / positive regulation of insulin receptor signaling pathway / nitric oxide-cGMP-mediated signaling / transport vesicle / positive regulation of protein autophosphorylation / dendrite membrane / Insulin receptor recycling / neuron projection maintenance / NPAS4 regulates expression of target genes / positive regulation of protein metabolic process / positive regulation of brown fat cell differentiation / positive regulation of glycolytic process / activation of protein kinase B activity / endoplasmic reticulum-Golgi intermediate compartment membrane / positive regulation of mitotic nuclear division / Insulin receptor signalling cascade / receptor-mediated endocytosis / learning / positive regulation of nitric-oxide synthase activity / positive regulation of cytokine production / positive regulation of long-term synaptic potentiation / caveola / acute-phase response / Regulation of insulin secretion / endosome lumen / positive regulation of protein secretion / positive regulation of glucose import / negative regulation of proteolysis / positive regulation of cell differentiation / regulation of transmembrane transporter activity / insulin-like growth factor receptor binding / positive regulation of MAP kinase activity / wound healing / insulin receptor binding / regulation of synaptic plasticity / negative regulation of protein catabolic process / hormone activity / receptor internalization / receptor protein-tyrosine kinase / memory / cognition / cellular response to growth factor stimulus / positive regulation of neuron projection development / positive regulation of protein localization to nucleus / Golgi lumen / peptidyl-tyrosine phosphorylation 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 7.6 Å | ||||||
 データ登録者 データ登録者 | Nielsen, J.A. / Slaaby, R. / Boesen, T. / Hummelshoj, T. / Brandt, J. / Schluckebier, G. / Nissen, P. | ||||||
| 資金援助 |  デンマーク, 1件 デンマーク, 1件
| ||||||
 引用 引用 |  ジャーナル: J Mol Biol / 年: 2022 ジャーナル: J Mol Biol / 年: 2022タイトル: Structural Investigations of Full-Length Insulin Receptor Dynamics and Signalling. 著者: Jeppe Nielsen / Jakob Brandt / Thomas Boesen / Tina Hummelshøj / Rita Slaaby / Gerd Schluckebier / Poul Nissen /  要旨: Insulin regulates glucose homeostasis via binding and activation of the insulin receptor dimer at two distinct pairs of binding sites 1 and 2. Here, we present cryo-EM studies of full-length human ...Insulin regulates glucose homeostasis via binding and activation of the insulin receptor dimer at two distinct pairs of binding sites 1 and 2. Here, we present cryo-EM studies of full-length human insulin receptor (hIR) in an active state obtained at non-saturating, physiologically relevant insulin conditions. Insulin binds asymmetrically to the receptor under these conditions, occupying up to three of the four possible binding sites. Deletion analysis of the receptor together with site specific peptides and insulin analogs used in binding studies show that both sites 1 and 2 are required for high insulin affinity. We identify a homotypic interaction of the fibronectin type III domain (FnIII-3) of IR resulting in tight interaction of membrane proximal domains of the active, asymmetric receptor dimer. Our results show how insulin binding at two distinct types of sites disrupts the autoinhibited apo-IR dimer and stabilizes the active dimer. We propose an insulin binding and activation mechanism, which is sequential, exhibits negative cooperativity, and is based on asymmetry at physiological insulin concentrations with one to three insulin molecules activating IR. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7pg0.cif.gz 7pg0.cif.gz | 333.6 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7pg0.ent.gz pdb7pg0.ent.gz | 265 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7pg0.json.gz 7pg0.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7pg0_validation.pdf.gz 7pg0_validation.pdf.gz | 920 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7pg0_full_validation.pdf.gz 7pg0_full_validation.pdf.gz | 988.3 KB | 表示 | |
| XML形式データ |  7pg0_validation.xml.gz 7pg0_validation.xml.gz | 69.3 KB | 表示 | |
| CIF形式データ |  7pg0_validation.cif.gz 7pg0_validation.cif.gz | 97.7 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/pg/7pg0 https://data.pdbj.org/pub/pdb/validation_reports/pg/7pg0 ftp://data.pdbj.org/pub/pdb/validation_reports/pg/7pg0 ftp://data.pdbj.org/pub/pdb/validation_reports/pg/7pg0 | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 156697.578 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: INSR Homo sapiens (ヒト) / 遺伝子: INSR発現宿主:  参照: UniProt: P06213, receptor protein-tyrosine kinase #2: タンパク質・ペプチド | 分子量: 2383.698 Da / 分子数: 3 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: INS / 発現宿主: Homo sapiens (ヒト) / 遺伝子: INS / 発現宿主:  #3: タンパク質・ペプチド | 分子量: 3433.953 Da / 分子数: 3 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: INS / 発現宿主: Homo sapiens (ヒト) / 遺伝子: INS / 発現宿主:  |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: DDM solubilised full-length human insulin receptor with three insulins bound タイプ: COMPLEX / Entity ID: all / 由来: MULTIPLE SOURCES | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.46 MDa / 実験値: YES | ||||||||||||||||||||
| 緩衝液 | pH: 7.8 | ||||||||||||||||||||
| 緩衝液成分 |
| ||||||||||||||||||||
| 試料 | 濃度: 4 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | ||||||||||||||||||||
| 試料支持 | グリッドの材料: COPPER / グリッドのタイプ: C-flat-2/2 | ||||||||||||||||||||
| 急速凍結 | 装置: LEICA EM GP / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 297 K / 詳細: Blotted for 3s prior to plunging |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2000 nm / 最小 デフォーカス(公称値): 500 nm |
| 撮影 | 平均露光時間: 15 sec. / 電子線照射量: 60 e/Å2 フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||
| 3次元再構成 | 解像度: 7.6 Å / 解像度の算出法: OTHER / 粒子像の数: 32763 / 詳細: Masked FSC calculated with GSFSC in cryoSPARC2. / 対称性のタイプ: POINT | ||||||||||||||||||||
| 原子モデル構築 | プロトコル: FLEXIBLE FIT |
 ムービー
ムービー コントローラー
コントローラー
















 PDBj
PDBj





















