+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-4575 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Full length GluA1/2-gamma8 complex | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | AMPAR / ion channel / GluA1 / GluA2 / tarp / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Phase 0 - rapid depolarisation / Phase 2 - plateau phase / Cargo concentration in the ER / axonal spine / positive regulation of locomotion involved in locomotory behavior / positive regulation of membrane potential / COPII-mediated vesicle transport / cellular response to ammonium ion / response to sucrose / L-type voltage-gated calcium channel complex ...Phase 0 - rapid depolarisation / Phase 2 - plateau phase / Cargo concentration in the ER / axonal spine / positive regulation of locomotion involved in locomotory behavior / positive regulation of membrane potential / COPII-mediated vesicle transport / cellular response to ammonium ion / response to sucrose / L-type voltage-gated calcium channel complex / neuron spine / myosin V binding / postsynaptic neurotransmitter receptor diffusion trapping / proximal dendrite / regulation of monoatomic ion transmembrane transport / channel regulator activity / LGI-ADAM interactions / protein phosphatase 2B binding / Trafficking of AMPA receptors / regulation of AMPA receptor activity / response to arsenic-containing substance / cellular response to L-glutamate / cellular response to dsRNA / dendritic spine membrane / long-term synaptic depression / beta-2 adrenergic receptor binding / Synaptic adhesion-like molecules / cellular response to peptide hormone stimulus / spine synapse / response to morphine / dendritic spine neck / dendritic spine cytoplasm / dendritic spine head / neuronal cell body membrane / cellular response to amine stimulus / response to psychosocial stress / peptide hormone receptor binding / spinal cord development / perisynaptic space / Activation of AMPA receptors / ligand-gated monoatomic cation channel activity / protein kinase A binding / AMPA glutamate receptor activity / response to lithium ion / Trafficking of GluR2-containing AMPA receptors / behavioral response to pain / transmission of nerve impulse / AMPA glutamate receptor clustering / kainate selective glutamate receptor activity / cellular response to glycine / adenylate cyclase binding / immunoglobulin binding / AMPA glutamate receptor complex / asymmetric synapse / extracellularly glutamate-gated ion channel activity / conditioned place preference / response to electrical stimulus / regulation of receptor recycling / ionotropic glutamate receptor complex / G-protein alpha-subunit binding / glutamate receptor binding / Unblocking of NMDA receptors, glutamate binding and activation / positive regulation of synaptic transmission / long-term memory / positive regulation of synaptic transmission, glutamatergic / regulation of synaptic transmission, glutamatergic / postsynaptic density, intracellular component / regulation of postsynaptic membrane neurotransmitter receptor levels / neuronal action potential / response to fungicide / voltage-gated calcium channel activity / synapse assembly / regulation of long-term synaptic depression / cytoskeletal protein binding / glutamate-gated receptor activity / extracellular ligand-gated monoatomic ion channel activity / cellular response to brain-derived neurotrophic factor stimulus / glutamate-gated calcium ion channel activity / presynaptic active zone membrane / somatodendritic compartment / dendrite membrane / ionotropic glutamate receptor binding / excitatory synapse / ligand-gated monoatomic ion channel activity involved in regulation of presynaptic membrane potential / ionotropic glutamate receptor signaling pathway / dendrite cytoplasm / positive regulation of excitatory postsynaptic potential / synaptic membrane / dendritic shaft / SNARE binding / response to cocaine / PDZ domain binding / calcium channel regulator activity / synaptic transmission, glutamatergic / transmitter-gated monoatomic ion channel activity involved in regulation of postsynaptic membrane potential / protein tetramerization / cellular response to amino acid stimulus / response to nutrient levels / neuromuscular junction / establishment of protein localization 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
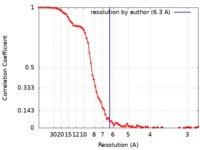
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 6.3 Å | |||||||||
 データ登録者 データ登録者 | Herguedas B / Garcia-Nafria J | |||||||||
 引用 引用 |  ジャーナル: Science / 年: 2019 ジャーナル: Science / 年: 2019タイトル: Architecture of the heteromeric GluA1/2 AMPA receptor in complex with the auxiliary subunit TARP γ8. 著者: Beatriz Herguedas / Jake F Watson / Hinze Ho / Ondrej Cais / Javier García-Nafría / Ingo H Greger /  要旨: AMPA-type glutamate receptors (AMPARs) mediate excitatory neurotransmission and are central regulators of synaptic plasticity, a molecular mechanism underlying learning and memory. Although AMPARs ...AMPA-type glutamate receptors (AMPARs) mediate excitatory neurotransmission and are central regulators of synaptic plasticity, a molecular mechanism underlying learning and memory. Although AMPARs act predominantly as heteromers, structural studies have focused on homomeric assemblies. Here, we present a cryo-electron microscopy structure of the heteromeric GluA1/2 receptor associated with two transmembrane AMPAR regulatory protein (TARP) γ8 auxiliary subunits, the principal AMPAR complex at hippocampal synapses. Within the receptor, the core subunits arrange to give the GluA2 subunit dominant control of gating. This structure reveals the geometry of the Q/R site that controls calcium flux, suggests association of TARP-stabilized lipids, and demonstrates that the extracellular loop of γ8 modulates gating by selectively interacting with the GluA2 ligand-binding domain. Collectively, this structure provides a blueprint for deciphering the signal transduction mechanisms of synaptic AMPARs. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_4575.map.gz emd_4575.map.gz | 6.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-4575-v30.xml emd-4575-v30.xml emd-4575.xml emd-4575.xml | 28.1 KB 28.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_4575_fsc.xml emd_4575_fsc.xml | 9.2 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_4575.png emd_4575.png | 65.2 KB | ||
| Filedesc metadata |  emd-4575.cif.gz emd-4575.cif.gz | 9 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-4575 http://ftp.pdbj.org/pub/emdb/structures/EMD-4575 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4575 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4575 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_4575.map.gz / 形式: CCP4 / 大きさ: 40.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_4575.map.gz / 形式: CCP4 / 大きさ: 40.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.4 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : GluA1/A2 bound to gamma-8
| 全体 | 名称: GluA1/A2 bound to gamma-8 |
|---|---|
| 要素 |
|
-超分子 #1: GluA1/A2 bound to gamma-8
| 超分子 | 名称: GluA1/A2 bound to gamma-8 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#3 |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 447 kDa/nm |
-分子 #1: GluA1
| 分子 | 名称: GluA1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 100.739602 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: ADYKDDDDKN FPNNIQIGGL FPNQQSQEHA AFRFALSQLT EPPKLLPQID IVNISDSFEM TYRFCSQFSK GVYAIFGFYE RRTVNMLTS FCGALHVCFI TPSFPVDTSN QFVLQLRPEL QEALISIIDH YKWQTFVYIY DADRGLSVLQ RVLDTAAEKN W QVTAVNIL ...文字列: ADYKDDDDKN FPNNIQIGGL FPNQQSQEHA AFRFALSQLT EPPKLLPQID IVNISDSFEM TYRFCSQFSK GVYAIFGFYE RRTVNMLTS FCGALHVCFI TPSFPVDTSN QFVLQLRPEL QEALISIIDH YKWQTFVYIY DADRGLSVLQ RVLDTAAEKN W QVTAVNIL TTTEEGYRML FQDLEKKKER LVVVDCESER LNAILGQIVK LEKNGIGYHY ILANLGFMDI DLNKFKESGA NV TGFQLVN YTDTIPARIM QQWRTSDSRD HTRVDWKRPK YTSALTYDGV KVMAEAFQSL RRQRIDISRR GNAGDCLANP AVP WGQGID IQRALQQVRF EGLTGNVQFN EKGRRTNYTL HVIEMKHDGI RKIGYWNEDD KFVPAATDAQ AGGDNSSVQN RTYI VTTIL EDPYVMLKKN ANQFEGNDRY EGYCVELAAE IAKHVGYSYR LEIVSDGKYG ARDPDTKAWN GMVGELVYGR ADVAV APLT ITLVREEVID FSKPFMSLGI SIMIKKPQKS KPGVFSFLDP LAYEIWMCIV FAYIGVSVVL FLVSRFSPYE WHSEEF EEG RDQTTSDQSN EFGIFNSLWF SLGAFMQQGC DISPRSLSGR IVGGVWWFFT LIIISSYTAN LAAFLTVERM VSPIESA ED LAKQTEIAYG TLEAGSTKEF FRRSKIAVFE KMWTYMKSAE PSVFVRTTEE GMIRVRKSKG KYAYLLESTM NEYIEQRK P CDTMKVGGNL DSKGYGIATP KGSALRGPVN LAVLKLSEQG VLDKLKSKWW YDKGECGSKD SGSKDKTSAL SLSNVAGVF YILIGGLGLA MLVALIEFCY KSRSESKRMK GFCLIPQQSI NEAIRTSTLP RNSGAGASGG GGSGENGRVV SQDFPKSMQS IPCMSHSSG MPLGATGL UniProtKB: Glutamate receptor 1 |
-分子 #2: Glutamate receptor 2
| 分子 | 名称: Glutamate receptor 2 / タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 93.880078 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: VSSNSIQIGG LFPRGADQEY SAFRVGMVQF STSEFRLTPH IDNLEVANSF AVTNAFCSQF SRGVYAIFGF YDKKSVNTIT SFCGTLHVS FITPSFPTDG THPFVIQMRP DLKGALLSLI EYYQWDKFAY LYDSDRGLST LQAVLDSAAE KKWQVTAINV G NINNDKKD ...文字列: VSSNSIQIGG LFPRGADQEY SAFRVGMVQF STSEFRLTPH IDNLEVANSF AVTNAFCSQF SRGVYAIFGF YDKKSVNTIT SFCGTLHVS FITPSFPTDG THPFVIQMRP DLKGALLSLI EYYQWDKFAY LYDSDRGLST LQAVLDSAAE KKWQVTAINV G NINNDKKD ETYRSLFQDL ELKKERRVIL DCERDKVNDI VDQVITIGKH VKGYHYIIAN LGFTDGDLLK IQFGGANVSG FQ IVDYDDS LVSKFIERWS TLEEKEYPGA HTATIKYTSA LTYDAVQVMT EAFRNLRKQR IEISRRGNAG DCLANPAVPW GQG VEIERA LKQVQVEGLS GNIKFDQNGK RINYTINIME LKTNGPRKIG YWSEVDKMVV TLTELPSGND TSGLENKTVV VTTI LESPY VMMKKNHEML EGNERYEGYC VDLAAEIAKH CGFKYKLTIV GDGKYGARDA DTKIWNGMVG ELVYGKADIA IAPLT ITLV REEVIDFSKP FMSLGISIMI KKPQKSKPGV FSFLDPLAYE IWMCIVFAYI GVSVVLFLVS RFSPYEWHTE EFEDGR ETQ SSESTNEFGI FNSLWFSLGA FMRQGCDISP RSLSGRIVGG VWWFFTLIII SSYTANLAAF LTVERMVSPI ESAEDLS KQ TEIAYGTLDS GSTKEFFRRS KIAVFDKMWT YMRSAEPSVF VRTTAEGVAR VRKSKGKYAY LLESTMNEYI EQRKPCDT M KVGGNLDSKG YGIATPKGSS LGTPVNLAVL KLSEQGVLDK LKNKWWYDKG ECGAKDSGSK EKTSALSLSN VAGVFYILV GGLGLAMLVA LIEFCYKSRA EAKRMKVAKN PQNINPSSS UniProtKB: Glutamate receptor 2 |
-分子 #3: Voltage-dependent calcium channel gamma-8 subunit
| 分子 | 名称: Voltage-dependent calcium channel gamma-8 subunit / タイプ: protein_or_peptide / ID: 3 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 43.592008 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: GESLKRWNEE RGLWCEKGVQ VLLTTIGAFA AFGLMTIAIS TDYWLYTRAL ICNTTNLTAG DDGPPHRGGS GSSEKKDPGG LTHSGLWRI CCLEGLKRGV CVKINHFPED TDYDHDSSEY LLRVVRASSI FPILSAILLL LGGVCVAASR VYKSKRNIIL G AGILFVAA ...文字列: GESLKRWNEE RGLWCEKGVQ VLLTTIGAFA AFGLMTIAIS TDYWLYTRAL ICNTTNLTAG DDGPPHRGGS GSSEKKDPGG LTHSGLWRI CCLEGLKRGV CVKINHFPED TDYDHDSSEY LLRVVRASSI FPILSAILLL LGGVCVAASR VYKSKRNIIL G AGILFVAA GLSNIIGVIV YISANAGEPG PKRDEEKKNH YSYGWSFYFG GLSFILAEVI GVLAVNIYIE RSREAHCQSR SD LLKAGGG AGGSGGSGPS AILRLPSYRF RYRRRSRSSS RGSSEASPSR DASPGGPGGP GFASTDISMY TLSRDPSKGS VAA GLASAG GGGGGAGVGA YGGAAGAAGG GGTGSERDRG SSAGFLTLHN AFPKEAASGV TVTVTGPPAA PAPAPPAPAA PAPG TLSKE AAASNTNTLN RKLEVLFQ UniProtKB: Voltage-dependent calcium channel gamma-8 subunit |
-分子 #6: 6-nitro-2,3-bis(oxidanylidene)-1,4-dihydrobenzo[f]quinoxaline-7-s...
| 分子 | 名称: 6-nitro-2,3-bis(oxidanylidene)-1,4-dihydrobenzo[f]quinoxaline-7-sulfonamide タイプ: ligand / ID: 6 / コピー数: 4 / 式: E2Q |
|---|---|
| 分子量 | 理論値: 336.28 Da |
| Chemical component information | 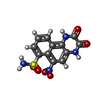 ChemComp-E2Q: |
-分子 #7: 2-acetamido-2-deoxy-beta-D-glucopyranose
| 分子 | 名称: 2-acetamido-2-deoxy-beta-D-glucopyranose / タイプ: ligand / ID: 7 / コピー数: 2 / 式: NAG |
|---|---|
| 分子量 | 理論値: 221.208 Da |
| Chemical component information |  ChemComp-NAG: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.4 mg/mL |
|---|---|
| 緩衝液 | pH: 8 詳細: 25 mM TRIS, pH 8, 150 mM NaCl and 0.1 % digitonin (w/v) |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV 詳細: 3uL on grid, 60 sec incubation and 4sec blotting time. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 温度 | 最低: 100.0 K / 最高: 100.0 K |
| 特殊光学系 | 位相板: VOLTA PHASE PLATE / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / デジタル化 - サイズ - 横: 3838 pixel / デジタル化 - サイズ - 縦: 3710 pixel / 撮影したグリッド数: 3 / 実像数: 5005 / 平均露光時間: 14.0 sec. / 平均電子線量: 32.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): -0.9 µm / 最小 デフォーカス(公称値): -0.2 µm / 倍率(公称値): 105000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー





















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)