+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-2546 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Helical reconstruction of ACAP1(BAR-PH domain) decorated membrane tubules by cryo-electron microscopy | |||||||||
 マップデータ マップデータ | Reconstruction of the first class of BarPH with diameter of 43.2nm | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | ACAP1 / BAR-PH domain / Electron microscopy / Membrane remodeling. | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報GTPase activator activity / recycling endosome membrane / protein transport / zinc ion binding / membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 15.0 Å | |||||||||
 データ登録者 データ登録者 | Pang XY / Fan J / Zhang Y / Zhang K / Gao BQ / Ma J / Li J / Deng YC / Zhou QJ / Hsu V / Sun F | |||||||||
 引用 引用 |  ジャーナル: Dev Cell / 年: 2014 ジャーナル: Dev Cell / 年: 2014タイトル: A PH domain in ACAP1 possesses key features of the BAR domain in promoting membrane curvature. 著者: Xiaoyun Pang / Jun Fan / Yan Zhang / Kai Zhang / Bingquan Gao / Jun Ma / Jian Li / Yuchen Deng / Qiangjun Zhou / Edward H Egelman / Victor W Hsu / Fei Sun /   要旨: The BAR (Bin-Amphiphysin-Rvs) domain undergoes dimerization to produce a curved protein structure, which superimposes onto membrane through electrostatic interactions to sense and impart membrane ...The BAR (Bin-Amphiphysin-Rvs) domain undergoes dimerization to produce a curved protein structure, which superimposes onto membrane through electrostatic interactions to sense and impart membrane curvature. In some cases, a BAR domain also possesses an amphipathic helix that inserts into the membrane to induce curvature. ACAP1 (Arfgap with Coil coil, Ankyrin repeat, and PH domain protein 1) contains a BAR domain. Here, we show that this BAR domain can neither bind membrane nor impart curvature, but instead requires a neighboring PH (Pleckstrin Homology) domain to achieve these functions. Specific residues within the PH domain are responsible for both membrane binding and curvature generation. The BAR domain adjacent to the PH domain instead interacts with the BAR domains of neighboring ACAP1 proteins to enable clustering at the membrane. Thus, we have uncovered the molecular basis for an unexpected and unconventional collaboration between PH and BAR domains in membrane bending. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_2546.map.gz emd_2546.map.gz | 9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-2546-v30.xml emd-2546-v30.xml emd-2546.xml emd-2546.xml | 13.1 KB 13.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  EMD-2546-cls1.tif EMD-2546-cls1.tif | 980.7 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-2546 http://ftp.pdbj.org/pub/emdb/structures/EMD-2546 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2546 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2546 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_2546_validation.pdf.gz emd_2546_validation.pdf.gz | 385.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_2546_full_validation.pdf.gz emd_2546_full_validation.pdf.gz | 385.3 KB | 表示 | |
| XML形式データ |  emd_2546_validation.xml.gz emd_2546_validation.xml.gz | 5.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2546 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2546 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2546 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2546 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_2546.map.gz / 形式: CCP4 / 大きさ: 29.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_2546.map.gz / 形式: CCP4 / 大きさ: 29.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Reconstruction of the first class of BarPH with diameter of 43.2nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 3.6 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
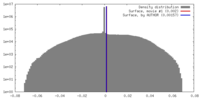
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : BARPH domain of ACAP1
| 全体 | 名称: BARPH domain of ACAP1 |
|---|---|
| 要素 |
|
-超分子 #1000: BARPH domain of ACAP1
| 超分子 | 名称: BARPH domain of ACAP1 / タイプ: sample / ID: 1000 詳細: 4 mg/ml ACAP1(BAR-PH) protein was incubated with 2 mg/ml liposome of 200nm at room temperature for 60min. 集合状態: tetramer / Number unique components: 1 |
|---|---|
| 分子量 | 実験値: 15.98 MDa / 理論値: 15.98 MDa / 手法: Theoretical computation |
-分子 #1: BAR-PH domain of ArfGAP with coiled coil, ANK repeat and PH domain
| 分子 | 名称: BAR-PH domain of ArfGAP with coiled coil, ANK repeat and PH domain タイプ: protein_or_peptide / ID: 1 / Name.synonym: BAR-PH domain of ACAP1 / コピー数: 107 / 集合状態: dimer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 別称: Human / Organelle: endosome / 細胞中の位置: Endosomal membrane Homo sapiens (ヒト) / 別称: Human / Organelle: endosome / 細胞中の位置: Endosomal membrane |
| 分子量 | 実験値: 9.2 MDa / 理論値: 9.2 MDa |
| 組換発現 | 生物種:  |
| 配列 | UniProtKB: Arf-GAP with coiled-coil, ANK repeat and PH domain-containing protein 1 GO: recycling endosome membrane InterPro: AH/BAR domain superfamily, Pleckstrin homology domain |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | helical array |
- 試料調製
試料調製
| 濃度 | 4 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 / 詳細: 50mM HEPES, pH7.4, 100mM NaCl |
| グリッド | 詳細: 300-mesh GiG holy carbon grid |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 98 K / 装置: FEI VITROBOT MARK IV 手法: The grid was blotted 3.0 s with a blot force 2 before plunging. |
| 詳細 | 4 mg/ml BARPH protein was incubated with 2mg/ml liposome of 200nm at room temperature for 60min. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 温度 | 最低: 93 K / 最高: 103 K / 平均: 98 K |
| 日付 | 2012年7月16日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: GATAN ULTRASCAN 4000 (4k x 4k) デジタル化 - サンプリング間隔: 15 µm / 実像数: 259 / 平均電子線量: 20 e/Å2 / ビット/ピクセル: 32 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 125418 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 3.5 µm / 最小 デフォーカス(公称値): 2.5 µm / 倍率(公称値): 75000 |
| 試料ステージ | 試料ホルダー: Liquid nitrogen 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 詳細 | The particles were aligned using IHRSR |
|---|---|
| 最終 再構成 | 想定した対称性 - らせんパラメータ - Δz: 23.2 Å 想定した対称性 - らせんパラメータ - ΔΦ: 93 ° 想定した対称性 - らせんパラメータ - 軸対称性: C3 (3回回転対称) アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 15.0 Å / 解像度の算出法: OTHER / ソフトウェア - 名称: IHRSR 詳細: The particles were shrunk 4 times to improve the alignment accuracy. Final maps were calculated from the datasets generated by 6 filaments with diameter of 43.2nm. |
| CTF補正 | 詳細: CTFFIND3 |
| 最終 角度割当 | 詳細: The Euler angles were determined by the projection angle. |
-原子モデル構築 1
| 初期モデル | PDB ID: Chain - #0 - Chain ID: A / Chain - #1 - Chain ID: B |
|---|---|
| ソフトウェア | 名称: Chimera plus manual docking |
| 詳細 | The ACAP1 dimer was separately fitted by manual docking and optimized using Chimera. Other dimers were generated by applying helical symmetry to the fitted one. |
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT / 当てはまり具合の基準: cross correlation |
| 得られたモデル |  PDB-4ckg:  PDB-5h3d: |
 ムービー
ムービー コントローラー
コントローラー














 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)