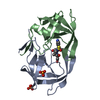
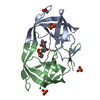
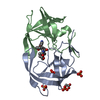
登録情報 データベース : PDB / ID : 1mtrタイトル HIV-1 PROTEASE COMPLEXED WITH A CYCLIC PHE-ILE-VAL PEPTIDOMIMETIC INHIBITOR HIV-1 PROTEASE キーワード / / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 手法 / / 解像度 : 1.75 Å データ登録者 Wickramasinghe, W. / Begun, J. / Martin, J.L. ジャーナル : J.Am.Chem.Soc. / 年 : 1996タイトル : Substrate-based cyclic peptidomimetics of Phe-Ile-Val that inhibit HIV-1 protease using a novel enzyme-binding mode.著者 : March, D.R. / Abbenante, G. / Bergman, D.A. / Brinkworth, R.I. / Wickramasinghe, W. / Begun, J. / Martin, J.L. / Fairlie, D.P. 履歴 登録 1996年2月15日 処理サイト 改定 1.0 1996年8月1日 Provider / タイプ 改定 1.1 2008年3月24日 Group 改定 1.2 2011年7月13日 Group Atomic model / Database references ... Atomic model / Database references / Derived calculations / Non-polymer description / Structure summary / Version format compliance 改定 1.3 2011年8月24日 Group 改定 1.4 2012年7月25日 Group 改定 1.5 2012年9月19日 Group 改定 1.6 2012年12月12日 Group 改定 1.7 2021年11月3日 Group / Derived calculations / Otherカテゴリ database_2 / pdbx_database_status ... database_2 / pdbx_database_status / struct_conn / struct_ref_seq_dif / struct_site Item _database_2.pdbx_DOI / _database_2.pdbx_database_accession ... _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_database_status.process_site / _struct_conn.pdbx_leaving_atom_flag / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id 改定 1.8 2023年8月9日 Group / カテゴリ
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 Human immunodeficiency virus 1 (ヒト免疫不全ウイルス)
Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) X線回折 / DIFFERENCE FOURIER / 解像度: 1.75 Å
X線回折 / DIFFERENCE FOURIER / 解像度: 1.75 Å  データ登録者
データ登録者 引用
引用 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 1mtr.cif.gz
1mtr.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb1mtr.ent.gz
pdb1mtr.ent.gz PDB形式
PDB形式 1mtr.json.gz
1mtr.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 1mtr_validation.pdf.gz
1mtr_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 1mtr_full_validation.pdf.gz
1mtr_full_validation.pdf.gz 1mtr_validation.xml.gz
1mtr_validation.xml.gz 1mtr_validation.cif.gz
1mtr_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/mt/1mtr
https://data.pdbj.org/pub/pdb/validation_reports/mt/1mtr ftp://data.pdbj.org/pub/pdb/validation_reports/mt/1mtr
ftp://data.pdbj.org/pub/pdb/validation_reports/mt/1mtr
 リンク
リンク 集合体
集合体
 要素
要素
 Human immunodeficiency virus 1 (ヒト免疫不全ウイルス)
Human immunodeficiency virus 1 (ヒト免疫不全ウイルス)
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 解析
解析 X-PLOR / バージョン: 3.1 / 分類: refinement
X-PLOR / バージョン: 3.1 / 分類: refinement ムービー
ムービー コントローラー
コントローラー

















 PDBj
PDBj