+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-10793 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the Full-length disease type human Huntingtin | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of cAMP-dependent protein kinase activity / regulation of phosphoprotein phosphatase activity / positive regulation of inositol 1,4,5-trisphosphate-sensitive calcium-release channel activity / microtubule-based transport / vocal learning / regulation of CAMKK-AMPK signaling cascade / positive regulation of mitophagy / profilin binding / vesicle transport along microtubule / positive regulation of cilium assembly ...regulation of cAMP-dependent protein kinase activity / regulation of phosphoprotein phosphatase activity / positive regulation of inositol 1,4,5-trisphosphate-sensitive calcium-release channel activity / microtubule-based transport / vocal learning / regulation of CAMKK-AMPK signaling cascade / positive regulation of mitophagy / profilin binding / vesicle transport along microtubule / positive regulation of cilium assembly / presynaptic cytosol / retrograde vesicle-mediated transport, Golgi to endoplasmic reticulum / positive regulation of aggrephagy / postsynaptic cytosol / positive regulation of lipophagy / dynein intermediate chain binding / beta-tubulin binding / Golgi organization / establishment of mitotic spindle orientation / dynactin binding / Regulation of MECP2 expression and activity / autophagosome / inclusion body / heat shock protein binding / centriole / negative regulation of extrinsic apoptotic signaling pathway / protein destabilization / cytoplasmic vesicle membrane / kinase binding / p53 binding / late endosome / transmembrane transporter binding / early endosome / positive regulation of apoptotic process / axon / apoptotic process / dendrite / perinuclear region of cytoplasm / Golgi apparatus / endoplasmic reticulum / protein-containing complex / nucleoplasm / identical protein binding / nucleus / cytoplasm / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
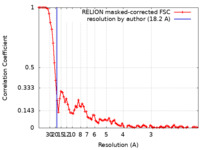
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 18.2 Å | |||||||||
 データ登録者 データ登録者 | Jung T / Tamo G / Dal Perraro M / Hebert H / Song J | |||||||||
| 資金援助 |  韓国, 2件 韓国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2020 ジャーナル: Structure / 年: 2020タイトル: The Polyglutamine Expansion at the N-Terminal of Huntingtin Protein Modulates the Dynamic Configuration and Phosphorylation of the C-Terminal HEAT Domain. 著者: Taeyang Jung / Baehyun Shin / Giorgio Tamo / Hyeongju Kim / Ravi Vijayvargia / Alexander Leitner / Maria J Marcaida / Juan Astorga-Wells / Roy Jung / Ruedi Aebersold / Matteo Dal Peraro / ...著者: Taeyang Jung / Baehyun Shin / Giorgio Tamo / Hyeongju Kim / Ravi Vijayvargia / Alexander Leitner / Maria J Marcaida / Juan Astorga-Wells / Roy Jung / Ruedi Aebersold / Matteo Dal Peraro / Hans Hebert / Ihn Sik Seong / Ji-Joon Song /     要旨: The polyQ expansion in huntingtin protein (HTT) is the prime cause of Huntington's disease (HD). The recent cryoelectron microscopy (cryo-EM) structure of HTT-HAP40 complex provided the structural ...The polyQ expansion in huntingtin protein (HTT) is the prime cause of Huntington's disease (HD). The recent cryoelectron microscopy (cryo-EM) structure of HTT-HAP40 complex provided the structural information on its HEAT-repeat domains. Here, we present analyses of the impact of polyQ length on the structure and function of HTT via an integrative structural and biochemical approach. The cryo-EM analysis of normal (Q23) and disease (Q78) type HTTs shows that the structures of apo HTTs significantly differ from the structure of HTT in a HAP40 complex and that the polyQ expansion induces global structural changes in the relative movements among the HTT domains. In addition, we show that the polyQ expansion alters the phosphorylation pattern across HTT and that Ser2116 phosphorylation in turn affects the global structure and function of HTT. These results provide a molecular basis for the effect of the polyQ segment on HTT structure and activity, which may be important for HTT pathology. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_10793.map.gz emd_10793.map.gz | 19.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-10793-v30.xml emd-10793-v30.xml emd-10793.xml emd-10793.xml | 18.9 KB 18.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_10793_fsc.xml emd_10793_fsc.xml | 8.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_10793.png emd_10793.png | 41 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-10793 http://ftp.pdbj.org/pub/emdb/structures/EMD-10793 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10793 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10793 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_10793_validation.pdf.gz emd_10793_validation.pdf.gz | 231.4 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_10793_full_validation.pdf.gz emd_10793_full_validation.pdf.gz | 230.5 KB | 表示 | |
| XML形式データ |  emd_10793_validation.xml.gz emd_10793_validation.xml.gz | 10.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10793 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10793 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10793 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10793 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_10793.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_10793.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.06 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Full-length human disease-type huntingtin
| 全体 | 名称: Full-length human disease-type huntingtin |
|---|---|
| 要素 |
|
-超分子 #1: Full-length human disease-type huntingtin
| 超分子 | 名称: Full-length human disease-type huntingtin / タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: A disease type huntingtin with 78 polyglutamine repeat tract |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 実験値: 350 KDa |
| 組換発現 | 生物種:  組換細胞: Sf9 cell / 組換プラスミド: pFASTBAC1 |
-分子 #1: Huntingtin
| 分子 | 名称: Huntingtin / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 355.278719 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MATLEKLMKA FESLKSFQQQ QQQQQQQQQQ QQQQQQQQQQ QQQQQQQQQQ QQQQQQQQQQ QQQQQQQQQQ QQQQQQQQQQ QQQQQQQQQ QQQQQQPPPP PPPPPPPQLP QPPPQAQPLL PQPQPPPPPP PPPPGPAVAE EPLHRPKKEL SATKKDRVNH C LTICENIV ...文字列: MATLEKLMKA FESLKSFQQQ QQQQQQQQQQ QQQQQQQQQQ QQQQQQQQQQ QQQQQQQQQQ QQQQQQQQQQ QQQQQQQQQQ QQQQQQQQQ QQQQQQPPPP PPPPPPPQLP QPPPQAQPLL PQPQPPPPPP PPPPGPAVAE EPLHRPKKEL SATKKDRVNH C LTICENIV AQSVRNSPEF QKLLGIAMEL FLLCSDDAES DVRMVADECL NKVIKALMDS NLPRLQLELY KEIKKNGAPR SL RAALWRF AELAHLVRPQ KCRPYLVNLL PCLTRTSKRP EESVQETLAA AVPKIMASFG NFANDNEIKV LLKAFIANLK SSS PTIRRT AAGSAVSICQ HSRRTQYFYS WLLNVLLGLL VPVEDEHSTL LILGVLLTLR YLVPLLQQQV KDTSLKGSFG VTRK EMEVS PSAEQLVQVY ELTLHHTQHQ DHNVVTGALE LLQQLFRTPP PELLQTLTAV GGIGQLTAAK EESGGRSRSG SIVEL IAGG GSSCSPVLSR KQKGKVLLGE EEALEDDSES RSDVSSSALT ASVKDEISGE LAASSGVSTP GSAGHDIITE QPRSQH TLQ ADSVDLASCD LTSSATDGDE EDILSHSSSQ VSAVPSDPAM DLNDGTQASS PISDSSQTTT EGPDSAVTPS DSSEIVL DG TDNQYLGLQI GQPQDEDEEA TGILPDEASE AFRNSSMALQ QAHLLKNMSH CRQPSDSSVD KFVLRDEATE PGDQENKP C RIKGDIGQST DDDSAPLVHC VRLLSASFLL TGGKNVLVPD RDVRVSVKAL ALSCVGAAVA LHPESFFSKL YKVPLDTTE YPEEQYVSDI LNYIDHGDPQ VRGATAILCG TLICSILSRS RFHVGDWMGT IRTLTGNTFS LADCIPLLRK TLKDESSVTC KLACTAVRN CVMSLCSSSY SELGLQLIID VLTLRNSSYW LVRTELLETL AEIDFRLVSF LEAKAENLHR GAHHYTGLLK L QERVLNNV VIHLLGDEDP RVRHVAAASL IRLVPKLFYK CDQGQADPVV AVARDQSSVY LKLLMHETQP PSHFSVSTIT RI YRGYNLL PSITDVTMEN NLSRVIAAVS HELITSTTRA LTFGCCEALC LLSTAFPVCI WSLGWHCGVP PLSASDESRK SCT VGMATM ILTLLSSAWF PLDLSAHQDA LILAGNLLAA SAPKSLRSSW ASEEEANPAA TKQEEVWPAL GDRALVPMVE QLFS HLLKV INICAHVLDD VAPGPAIKAA LPSLTNPPSL SPIRRKGKEK EPGEQASVPL SPKKGSEASA ASRQSDTSGP VTTSK SSSL GSFYHLPSYL RLHDVLKATH ANYKVTLDLQ NSTEKFGGFL RSALDVLSQI LELATLQDIG KCVEEILGYL KSCFSR EPM MATVCVQQLL KTLFGTNLAS QFDGLSSNPS KSQGRAQRLG SSSVRPGLYH YCFMAPYTHF TQALADASLR NMVQAEQ EN DTSGWFDVLQ KVSTQLKTNL TSVTKNRADK NAIHNHIRLF EPLVIKALKQ YTTTTCVQLQ KQVLDLLAQL VQLRVNYC L LDSDQVFIGF VLKQFEYIEV GQFRESEAII PNIFFFLVLL SYERYHSKQI IGIPKIIQLC DGIMASGRKA VTHAIPALQ PIVHDLFVLR GTNKADAGKE LETQKEVVVS MLLRLIQYHQ VLEMFILVLQ QCHKENEDKW KRLSRQIADI ILPMLAKQQM HIDSHEALG VLNTLFEILA PSSLRPVDML LRSMFVTPNT MASVSTVQLW ISGILAILRV LISQSTEDIV LSRIQELSFS P YLISCTVI NRLRDGDSTS TLEEHSEGKQ IKNLPEETFS RFLLQLVGIL LEDIVTKQLK VEMSEQQHTF YCQELGTLLM CL IHIFKSG MFRRITAAAT RLFRSDGCGG SFYTLDSLNL RARSMITTHP ALVLLWCQIL LLVNHTDYRW WAEVQQTPKR HSL SSTKLL SPQMSGEEED SDLAAKLGMC NREIVRRGAL ILFCDYVCQN LHDSEHLTWL IVNHIQDLIS LSHEPPVQDF ISAV HRNSA ASGLFIQAIQ SRCENLSTPT MLKKTLQCLE GIHLSQSGAV LTLYVDRLLC TPFRVLARMV DILACRRVEM LLAAN LQSS MAQLPMEELN RIQEYLQSSG LAQRHQRLYS LLDRFRLSTM QDSLSPSPPV SSHPLDGDGH VSLETVSPDK DWYVHL VKS QCWTRSDSAL LEGAELVNRI PAEDMNAFMM NSEFNLSLLA PCLSLGMSEI SGGQKSALFE AAREVTLARV SGTVQQL PA VHHVFQPELP AEPAAYWSKL NDLFGDAALY QSLPTLARAL AQYLVVVSKL PSHLHLPPEK EKDIVKFVVA TLEALSWH L IHEQIPLSLD LQAGLDCCCL ALQLPGLWSV VSSTEFVTHA CSLIHCVHFI LEAVAVQPGE QLLSPERRTN TPKAISEEE EEVDPNTQNP KYITAACEMV AEMVESLQSV LALGHKRNSG VPAFLTPLLR NIIISLARLP LVNSYTRVPP LVWKLGWSPK PGGDFGTAF PEIPVEFLQE KEVFKEFIYR INTLGWTSRT QFEETWATLL GVLVTQPLVM EQEESPPEED TERTQINVLA V QAITSLVL SAMTVPVAGN PAVSCLEQQP RNKPLKALDT RFGRKLSIIR GIVEQEIQAM VSKRENIATH HLYQAWDPVP SL SPATTGA LISHEKLLLQ INPERELGSM SYKLGQVSIH SVWLGNSITP LREEEWDEEE EEEADAPAPS SPPTSPVNSR KHR AGVDIH SCSQFLLELY SRWILPSSSA RRTPAILISE VVRSLLVVSD LFTERNQFEL MYVTLTELRR VHPSEDEILA QYLV PATCK AAAVLGMDKA VAEPVSRLLE STLRSSHLPS RVGALHGVLY VLECDLLDDT AKQLIPVISD YLLSNLKGIA HCVNI HSQQ HVLVMCATAF YLIENYPLDV GPEFSASIIQ MCGVMLSGSE ESTPSIIYHC ALRGLERLLL SEQLSRLDAE SLVKLS VDR VNVHSPHRAM AALGLMLTCM YTGKEKVSPG RTSDPNPAAP DSESVIVAME RVSVLFDRIR KGFPCEARVV ARILPQF LD DFFPPQDIMN KVIGEFLSNQ QPYPQFMATV VYKVFQTLHS TGQSSMVRDW VMLSLSNFTQ RAPVAMATWS LSCFFVSA S TSPWVAAILP HVISRMGKLE QVDVNLFCLV ATDFYRHQIE EELDRRAFQS VLEVVAAPGS PYHRLLTCLR NVHKVTTC |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.08 mg/mL | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
| |||||||||
| グリッド | モデル: Quantifoil R2/2 / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: GRAPHENE OXIDE / 支持フィルム - トポロジー: CONTINUOUS / 前処理 - タイプ: GLOW DISCHARGE | |||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 288 K / 装置: FEI VITROBOT MARK II / 詳細: 30 seconds incubation 8 seconds blotting. | |||||||||
| 詳細 | HTT was mixed with final 0.05% of Octyl glucoside. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | 位相板: VOLTA PHASE PLATE / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / デジタル化 - 画像ごとのフレーム数: 1-24 / 実像数: 1500 / 平均露光時間: 6.0 sec. / 平均電子線量: 33.6 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 47170 / 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 0.4 µm / 最小 デフォーカス(公称値): 0.4 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー