+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7klr | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
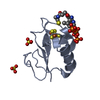
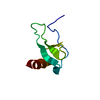
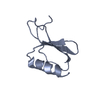
| タイトル | Solution structure of the PHD1 domain of histone demethylase KDM5A in complex with a histone H3(1-10) peptide | |||||||||
 要素 要素 |
| |||||||||
 キーワード キーワード |  GENE REGULATION (遺伝子発現の調節) / PHD / H3 / GENE REGULATION (遺伝子発現の調節) / PHD / H3 /  Epigenetics (エピジェネティクス) / Epigenetics (エピジェネティクス) /  KDM5A KDM5A | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報[histone H3]-trimethyl-L-lysine4 demethylase / facultative heterochromatin formation / histone H3K4me/H3K4me2/H3K4me3 demethylase activity /  enzyme inhibitor activity / regulation of DNA-binding transcription factor activity / histone demethylase activity / Chromatin modifying enzymes / epigenetic regulation of gene expression / methylated histone binding / telomere organization ...[histone H3]-trimethyl-L-lysine4 demethylase / facultative heterochromatin formation / histone H3K4me/H3K4me2/H3K4me3 demethylase activity / enzyme inhibitor activity / regulation of DNA-binding transcription factor activity / histone demethylase activity / Chromatin modifying enzymes / epigenetic regulation of gene expression / methylated histone binding / telomere organization ...[histone H3]-trimethyl-L-lysine4 demethylase / facultative heterochromatin formation / histone H3K4me/H3K4me2/H3K4me3 demethylase activity /  enzyme inhibitor activity / regulation of DNA-binding transcription factor activity / histone demethylase activity / Chromatin modifying enzymes / epigenetic regulation of gene expression / methylated histone binding / telomere organization / RNA Polymerase I Promoter Opening / Interleukin-7 signaling / Assembly of the ORC complex at the origin of replication / enzyme inhibitor activity / regulation of DNA-binding transcription factor activity / histone demethylase activity / Chromatin modifying enzymes / epigenetic regulation of gene expression / methylated histone binding / telomere organization / RNA Polymerase I Promoter Opening / Interleukin-7 signaling / Assembly of the ORC complex at the origin of replication /  DNAメチル化 / Condensation of Prophase Chromosomes / HCMV Late Events / Chromatin modifications during the maternal to zygotic transition (MZT) / ERCC6 (CSB) and EHMT2 (G9a) positively regulate rRNA expression / SIRT1 negatively regulates rRNA expression / PRC2 methylates histones and DNA / Defective pyroptosis / HDACs deacetylate histones / RNA Polymerase I Promoter Escape / Transcriptional regulation by small RNAs / Formation of the beta-catenin:TCF transactivating complex / circadian regulation of gene expression / RUNX1 regulates genes involved in megakaryocyte differentiation and platelet function / Activated PKN1 stimulates transcription of AR (androgen receptor) regulated genes KLK2 and KLK3 / NoRC negatively regulates rRNA expression / B-WICH complex positively regulates rRNA expression / HDMs demethylate histones / chromatin DNA binding / PKMTs methylate histone lysines / RMTs methylate histone arginines / DNAメチル化 / Condensation of Prophase Chromosomes / HCMV Late Events / Chromatin modifications during the maternal to zygotic transition (MZT) / ERCC6 (CSB) and EHMT2 (G9a) positively regulate rRNA expression / SIRT1 negatively regulates rRNA expression / PRC2 methylates histones and DNA / Defective pyroptosis / HDACs deacetylate histones / RNA Polymerase I Promoter Escape / Transcriptional regulation by small RNAs / Formation of the beta-catenin:TCF transactivating complex / circadian regulation of gene expression / RUNX1 regulates genes involved in megakaryocyte differentiation and platelet function / Activated PKN1 stimulates transcription of AR (androgen receptor) regulated genes KLK2 and KLK3 / NoRC negatively regulates rRNA expression / B-WICH complex positively regulates rRNA expression / HDMs demethylate histones / chromatin DNA binding / PKMTs methylate histone lysines / RMTs methylate histone arginines /  遺伝的組換え / Pre-NOTCH Transcription and Translation / 遺伝的組換え / Pre-NOTCH Transcription and Translation /  nucleosome assembly / Activation of anterior HOX genes in hindbrain development during early embryogenesis / HCMV Early Events / Transcriptional regulation of granulopoiesis / structural constituent of chromatin / nucleosome assembly / Activation of anterior HOX genes in hindbrain development during early embryogenesis / HCMV Early Events / Transcriptional regulation of granulopoiesis / structural constituent of chromatin /  ヌクレオソーム / ヌクレオソーム /  遺伝子発現 / RUNX1 regulates transcription of genes involved in differentiation of HSCs / chromatin organization / Factors involved in megakaryocyte development and platelet production / HATs acetylate histones / 遺伝子発現 / RUNX1 regulates transcription of genes involved in differentiation of HSCs / chromatin organization / Factors involved in megakaryocyte development and platelet production / HATs acetylate histones /  histone binding / Senescence-Associated Secretory Phenotype (SASP) / Oxidative Stress Induced Senescence / Estrogen-dependent gene expression / histone binding / Senescence-Associated Secretory Phenotype (SASP) / Oxidative Stress Induced Senescence / Estrogen-dependent gene expression /  transcription coactivator activity / transcription cis-regulatory region binding / transcription coactivator activity / transcription cis-regulatory region binding /  クロマチンリモデリング / クロマチンリモデリング /  cadherin binding / Amyloid fiber formation / protein heterodimerization activity / cadherin binding / Amyloid fiber formation / protein heterodimerization activity /  クロマチン / クロマチン /  核小体 / regulation of DNA-templated transcription / positive regulation of DNA-templated transcription / negative regulation of transcription by RNA polymerase II / protein-containing complex / 核小体 / regulation of DNA-templated transcription / positive regulation of DNA-templated transcription / negative regulation of transcription by RNA polymerase II / protein-containing complex /  DNA binding / extracellular exosome / zinc ion binding / extracellular region / DNA binding / extracellular exosome / zinc ion binding / extracellular region /  核質 / 核質 /  生体膜 / 生体膜 /  細胞核 細胞核類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 |  溶液NMR / 溶液NMR /  simulated annealing simulated annealing | |||||||||
 データ登録者 データ登録者 | Longbotham, E.J. / Kelly, M.J.S. / Fujimori, D.G. | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Acs Chem.Biol. / 年: 2021 ジャーナル: Acs Chem.Biol. / 年: 2021タイトル: Recognition of Histone H3 Methylation States by the PHD1 Domain of Histone Demethylase KDM5A. 著者: Longbotham, J.E. / Kelly, M.J.S. / Fujimori, D.G. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7klr.cif.gz 7klr.cif.gz | 414.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7klr.ent.gz pdb7klr.ent.gz | 355.6 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7klr.json.gz 7klr.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/kl/7klr https://data.pdbj.org/pub/pdb/validation_reports/kl/7klr ftp://data.pdbj.org/pub/pdb/validation_reports/kl/7klr ftp://data.pdbj.org/pub/pdb/validation_reports/kl/7klr | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  7kloC C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| その他のデータベース |
|
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| |||||||||
| NMR アンサンブル |
|
- 要素
要素
| #1: タンパク質 | 分子量: 6605.556 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: KDM5A, JARID1A, RBBP2, RBP2 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: KDM5A, JARID1A, RBBP2, RBP2 / 発現宿主:   Escherichia coli BL21(DE3) (大腸菌) / 株 (発現宿主): BL21(DE3) Escherichia coli BL21(DE3) (大腸菌) / 株 (発現宿主): BL21(DE3)参照: UniProt: P29375, [histone H3]-trimethyl-L-lysine4 demethylase | ||
|---|---|---|---|
| #2: タンパク質・ペプチド |  ヒストンH3 / Histone H3/a / Histone H3/b / Histone H3/c / Histone H3/d / Histone H3/f / Histone H3/h / Histone ...Histone H3/a / Histone H3/b / Histone H3/c / Histone H3/d / Histone H3/f / Histone H3/h / Histone H3/i / Histone H3/j / Histone H3/k / Histone H3/l ヒストンH3 / Histone H3/a / Histone H3/b / Histone H3/c / Histone H3/d / Histone H3/f / Histone H3/h / Histone ...Histone H3/a / Histone H3/b / Histone H3/c / Histone H3/d / Histone H3/f / Histone H3/h / Histone H3/i / Histone H3/j / Histone H3/k / Histone H3/l分子量: 1150.332 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) Homo sapiens (ヒト)遺伝子: H3C1, H3FA, HIST1H3A, H3C2, H3FL, HIST1H3B, H3C3, H3FC HIST1H3C, H3C4, H3FB, HIST1H3D, H3C6, H3FD, HIST1H3E, H3C7, H3FI, HIST1H3F, H3C8, H3FH, HIST1H3G, H3C10, H3FK, HIST1H3H, H3C11, H3FF, ...遺伝子: H3C1, H3FA, HIST1H3A, H3C2, H3FL, HIST1H3B, H3C3, H3FC HIST1H3C, H3C4, H3FB, HIST1H3D, H3C6, H3FD, HIST1H3E, H3C7, H3FI, HIST1H3F, H3C8, H3FH, HIST1H3G, H3C10, H3FK, HIST1H3H, H3C11, H3FF, HIST1H3I, H3C12, H3FJ, HIST1H3J 発現宿主: synthetic construct (人工物) / 参照: UniProt: P68431 | ||
| #3: 化合物 | | 研究の焦点であるリガンドがあるか | N | |
-実験情報
-実験
| 実験 | 手法:  溶液NMR 溶液NMR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NMR実験 |
|
- 試料調製
試料調製
| 詳細 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 試料 |
|
 ムービー
ムービー コントローラー
コントローラー










 PDBj
PDBj









