| 登録情報 | データベース: PDB / ID: 6zgx
|
|---|
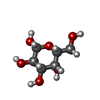
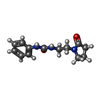
| タイトル | Structure of human galactokinase 1 bound with 2-(4-chlorophenyl)-N-(pyrimidin-2-yl)acetamide |
|---|
 要素 要素 | Galactokinase ガラクトキナーゼ ガラクトキナーゼ |
|---|
 キーワード キーワード |  TRANSFERASE (転移酵素) / TRANSFERASE (転移酵素) /  GALK1 (ガラクトキナーゼ) / GALK1 (ガラクトキナーゼ) /  galactokinase 1 (ガラクトキナーゼ) / fragment screening / allosteric fragment / binding hotspt galactokinase 1 (ガラクトキナーゼ) / fragment screening / allosteric fragment / binding hotspt |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
glycolytic process from galactose / Defective GALK1 causes GALCT2 / galactitol metabolic process /  ガラクトキナーゼ / ガラクトキナーゼ /  galactokinase activity / galactose catabolic process / Galactose catabolism / galactose catabolic process via UDP-galactose / galactokinase activity / galactose catabolic process / Galactose catabolism / galactose catabolic process via UDP-galactose /  galactose binding / galactose metabolic process ...glycolytic process from galactose / Defective GALK1 causes GALCT2 / galactitol metabolic process / galactose binding / galactose metabolic process ...glycolytic process from galactose / Defective GALK1 causes GALCT2 / galactitol metabolic process /  ガラクトキナーゼ / ガラクトキナーゼ /  galactokinase activity / galactose catabolic process / Galactose catabolism / galactose catabolic process via UDP-galactose / galactokinase activity / galactose catabolic process / Galactose catabolism / galactose catabolic process via UDP-galactose /  galactose binding / galactose metabolic process / extracellular exosome / galactose binding / galactose metabolic process / extracellular exosome /  ATP binding / ATP binding /  生体膜 / 生体膜 /  細胞質基質 / 細胞質基質 /  細胞質類似検索 - 分子機能 細胞質類似検索 - 分子機能  Galactokinase, N-terminal domain / Galactokinase, N-terminal domain /  Galactokinase, conserved site / Galactokinase galactose-binding signature / Galactokinase signature. / Galactokinase, conserved site / Galactokinase galactose-binding signature / Galactokinase signature. /  ガラクトキナーゼ / Mevalonate/galactokinase / GHMP kinase, ATP-binding, conserved site / GHMP kinases putative ATP-binding domain. / GHMP kinase, C-terminal domain / GHMP kinases C terminal ... ガラクトキナーゼ / Mevalonate/galactokinase / GHMP kinase, ATP-binding, conserved site / GHMP kinases putative ATP-binding domain. / GHMP kinase, C-terminal domain / GHMP kinases C terminal ... Galactokinase, N-terminal domain / Galactokinase, N-terminal domain /  Galactokinase, conserved site / Galactokinase galactose-binding signature / Galactokinase signature. / Galactokinase, conserved site / Galactokinase galactose-binding signature / Galactokinase signature. /  ガラクトキナーゼ / Mevalonate/galactokinase / GHMP kinase, ATP-binding, conserved site / GHMP kinases putative ATP-binding domain. / GHMP kinase, C-terminal domain / GHMP kinases C terminal / GHMP kinase N-terminal domain / GHMP kinases N terminal domain / GHMP kinase, C-terminal domain superfamily / ガラクトキナーゼ / Mevalonate/galactokinase / GHMP kinase, ATP-binding, conserved site / GHMP kinases putative ATP-binding domain. / GHMP kinase, C-terminal domain / GHMP kinases C terminal / GHMP kinase N-terminal domain / GHMP kinases N terminal domain / GHMP kinase, C-terminal domain superfamily /  Ribosomal protein S5 domain 2-type fold, subgroup / Ribosomal protein S5 domain 2-type fold, subgroup /  Ribosomal protein S5 domain 2-type fold類似検索 - ドメイン・相同性 Ribosomal protein S5 domain 2-type fold類似検索 - ドメイン・相同性beta-D-galactopyranose / Chem-HFK / Chem-S6V /  ガラクトキナーゼ類似検索 - 構成要素 ガラクトキナーゼ類似検索 - 構成要素 |
|---|
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.86 Å 分子置換 / 解像度: 1.86 Å |
|---|
 データ登録者 データ登録者 | Mackinnon, S.R. / Bezerra, G.A. / Zhang, M. / Foster, W. / Krojer, T. / Brandao-Neto, J. / Douangamath, A. / Arrowsmith, C. / Edwards, A. / Bountra, C. ...Mackinnon, S.R. / Bezerra, G.A. / Zhang, M. / Foster, W. / Krojer, T. / Brandao-Neto, J. / Douangamath, A. / Arrowsmith, C. / Edwards, A. / Bountra, C. / Brennan, P. / Lai, K. / Yue, W.W. |
|---|
| 資金援助 |  英国, 1件 英国, 1件 | 組織 | 認可番号 | 国 |
|---|
| Wellcome Trust | 092809/Z/10/Z |  英国 英国 |
|
|---|
 引用 引用 |  ジャーナル: Acs Chem.Biol. / 年: 2021 ジャーナル: Acs Chem.Biol. / 年: 2021
タイトル: Fragment Screening Reveals Starting Points for Rational Design of Galactokinase 1 Inhibitors to Treat Classic Galactosemia.
著者: Mackinnon, S.R. / Krojer, T. / Foster, W.R. / Diaz-Saez, L. / Tang, M. / Huber, K.V.M. / von Delft, F. / Lai, K. / Brennan, P.E. / Arruda Bezerra, G. / Yue, W.W. |
|---|
| 履歴 | | 登録 | 2020年6月20日 | 登録サイト: PDBE / 処理サイト: PDBE |
|---|
| 改定 1.0 | 2020年7月29日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2021年4月7日 | Group: Database references / カテゴリ: citation / citation_author
Item: _citation.country / _citation.journal_abbrev ..._citation.country / _citation.journal_abbrev / _citation.journal_id_CSD / _citation.journal_id_ISSN / _citation.pdbx_database_id_DOI / _citation.pdbx_database_id_PubMed / _citation.title / _citation.year |
|---|
| 改定 1.2 | 2021年4月28日 | Group: Database references / カテゴリ: citation / citation_author
Item: _citation.journal_volume / _citation.page_first ..._citation.journal_volume / _citation.page_first / _citation.page_last / _citation_author.identifier_ORCID |
|---|
| 改定 1.3 | 2024年1月24日 | Group: Data collection / Database references / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 ガラクトキナーゼ
ガラクトキナーゼ  キーワード
キーワード TRANSFERASE (転移酵素) /
TRANSFERASE (転移酵素) /  GALK1 (ガラクトキナーゼ) /
GALK1 (ガラクトキナーゼ) /  galactokinase 1 (ガラクトキナーゼ) / fragment screening / allosteric fragment / binding hotspt
galactokinase 1 (ガラクトキナーゼ) / fragment screening / allosteric fragment / binding hotspt 機能・相同性情報
機能・相同性情報 ガラクトキナーゼ /
ガラクトキナーゼ /  galactokinase activity / galactose catabolic process / Galactose catabolism / galactose catabolic process via UDP-galactose /
galactokinase activity / galactose catabolic process / Galactose catabolism / galactose catabolic process via UDP-galactose /  galactose binding / galactose metabolic process ...glycolytic process from galactose / Defective GALK1 causes GALCT2 / galactitol metabolic process /
galactose binding / galactose metabolic process ...glycolytic process from galactose / Defective GALK1 causes GALCT2 / galactitol metabolic process /  ガラクトキナーゼ /
ガラクトキナーゼ /  galactokinase activity / galactose catabolic process / Galactose catabolism / galactose catabolic process via UDP-galactose /
galactokinase activity / galactose catabolic process / Galactose catabolism / galactose catabolic process via UDP-galactose /  galactose binding / galactose metabolic process / extracellular exosome /
galactose binding / galactose metabolic process / extracellular exosome /  ATP binding /
ATP binding /  生体膜 /
生体膜 /  細胞質基質 /
細胞質基質 /  細胞質
細胞質
 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.86 Å
分子置換 / 解像度: 1.86 Å  データ登録者
データ登録者 英国, 1件
英国, 1件  引用
引用 ジャーナル: Acs Chem.Biol. / 年: 2021
ジャーナル: Acs Chem.Biol. / 年: 2021 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6zgx.cif.gz
6zgx.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6zgx.ent.gz
pdb6zgx.ent.gz PDB形式
PDB形式 6zgx.json.gz
6zgx.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/zg/6zgx
https://data.pdbj.org/pub/pdb/validation_reports/zg/6zgx ftp://data.pdbj.org/pub/pdb/validation_reports/zg/6zgx
ftp://data.pdbj.org/pub/pdb/validation_reports/zg/6zgx リンク
リンク 集合体
集合体
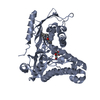



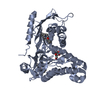
 要素
要素 ガラクトキナーゼ / Galactose kinase
ガラクトキナーゼ / Galactose kinase
 Homo sapiens (ヒト) / 遺伝子: GALK1, GALK / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: GALK1, GALK / 発現宿主: 
 Escherichia coli BL21(DE3) (大腸菌) / 参照: UniProt: P51570,
Escherichia coli BL21(DE3) (大腸菌) / 参照: UniProt: P51570,  ガラクトキナーゼ
ガラクトキナーゼ ガラクトース
ガラクトース 水
水 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製
 シンクロトロン / サイト:
シンクロトロン / サイト:  Diamond
Diamond  / ビームライン: I04-1 / 波長: 0.91587 Å
/ ビームライン: I04-1 / 波長: 0.91587 Å : 0.91587 Å / 相対比: 1
: 0.91587 Å / 相対比: 1 
 分子置換
分子置換 解析
解析 :
:  分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー


















 PDBj
PDBj