+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 5d7p | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Crystal structure of human Sirt2 in complex with ADPR and EX-243 | |||||||||
 要素 要素 | NAD-dependent protein deacetylase sirtuin-2 | |||||||||
 キーワード キーワード |  HYDROLASE (加水分解酵素) / HYDROLASE (加水分解酵素) /  Human Sirtuin 2 / Human Sirtuin 2 /  Inhibitor complex (酵素阻害剤) / Deacylase Inhibitor complex (酵素阻害剤) / Deacylase | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cellular response to caloric restriction / negative regulation of oligodendrocyte progenitor proliferation / cellular lipid catabolic process / negative regulation of striated muscle tissue development / positive regulation of meiotic nuclear division / NAD-dependent histone H4K16 deacetylase activity / : / positive regulation of attachment of spindle microtubules to kinetochore / NAD-dependent protein demyristoylase activity / NAD-dependent protein depalmitoylase activity ...cellular response to caloric restriction / negative regulation of oligodendrocyte progenitor proliferation / cellular lipid catabolic process / negative regulation of striated muscle tissue development / positive regulation of meiotic nuclear division / NAD-dependent histone H4K16 deacetylase activity / : / positive regulation of attachment of spindle microtubules to kinetochore / NAD-dependent protein demyristoylase activity / NAD-dependent protein depalmitoylase activity / paranodal junction / tubulin deacetylation / lateral loop / NLRP3 inflammasome complex assembly / peptidyl-lysine deacetylation / mitotic nuclear membrane reassembly / negative regulation of NLRP3 inflammasome complex assembly / tubulin deacetylase activity / regulation of exit from mitosis / paranode region of axon / Schmidt-Lanterman incisure / NAD-dependent protein lysine deacetylase activity / positive regulation of fatty acid biosynthetic process /  myelination in peripheral nervous system / rDNA heterochromatin formation / protein acetyllysine N-acetyltransferase / NAD-dependent histone deacetylase activity / chromatin silencing complex / myelination in peripheral nervous system / rDNA heterochromatin formation / protein acetyllysine N-acetyltransferase / NAD-dependent histone deacetylase activity / chromatin silencing complex /  regulation of phosphorylation / Initiation of Nuclear Envelope (NE) Reformation / protein deacetylation / juxtaparanode region of axon / positive regulation of oocyte maturation / protein lysine deacetylase activity / regulation of phosphorylation / Initiation of Nuclear Envelope (NE) Reformation / protein deacetylation / juxtaparanode region of axon / positive regulation of oocyte maturation / protein lysine deacetylase activity /  紡錘体 / response to redox state / 紡錘体 / response to redox state /  histone deacetylase activity / histone deacetylase activity /  regulation of myelination / regulation of myelination /  histone acetyltransferase binding / negative regulation of fat cell differentiation / positive regulation of execution phase of apoptosis / negative regulation of peptidyl-threonine phosphorylation / glial cell projection / subtelomeric heterochromatin formation / positive regulation of cell division / histone acetyltransferase binding / negative regulation of fat cell differentiation / positive regulation of execution phase of apoptosis / negative regulation of peptidyl-threonine phosphorylation / glial cell projection / subtelomeric heterochromatin formation / positive regulation of cell division /  NAD+ ADP-ribosyltransferase activity / NAD+ ADP-ribosyltransferase activity /  NAD+ binding / negative regulation of reactive oxygen species metabolic process / positive regulation of DNA binding / NAD+ binding / negative regulation of reactive oxygen species metabolic process / positive regulation of DNA binding /  ヘテロクロマチン / heterochromatin formation / epigenetic regulation of gene expression / ヘテロクロマチン / heterochromatin formation / epigenetic regulation of gene expression /  転移酵素; アシル基を移すもの; アミノアシル基以外のアシル基を移すもの / cellular response to epinephrine stimulus / substantia nigra development / 転移酵素; アシル基を移すもの; アミノアシル基以外のアシル基を移すもの / cellular response to epinephrine stimulus / substantia nigra development /  中心小体 / negative regulation of autophagy / meiotic cell cycle / 中心小体 / negative regulation of autophagy / meiotic cell cycle /  ubiquitin binding / negative regulation of protein catabolic process / ubiquitin binding / negative regulation of protein catabolic process /  紡錘体 / spindle / 紡錘体 / spindle /  オートファジー / オートファジー /  histone deacetylase binding / positive regulation of proteasomal ubiquitin-dependent protein catabolic process / histone deacetylase binding / positive regulation of proteasomal ubiquitin-dependent protein catabolic process /  髄鞘 / cellular response to oxidative stress / 髄鞘 / cellular response to oxidative stress /  染色体 / midbody / 染色体 / midbody /  成長円錐 / cellular response to hypoxia / 成長円錐 / cellular response to hypoxia /  perikaryon / proteasome-mediated ubiquitin-dependent protein catabolic process / DNA-binding transcription factor binding / perikaryon / proteasome-mediated ubiquitin-dependent protein catabolic process / DNA-binding transcription factor binding /  微小管 / 微小管 /  chromosome, telomeric region / chromosome, telomeric region /  regulation of cell cycle / regulation of cell cycle /  細胞分裂 / 細胞分裂 /  自然免疫系 / negative regulation of DNA-templated transcription / 自然免疫系 / negative regulation of DNA-templated transcription /  中心体 / 中心体 /  chromatin binding / chromatin binding /  核小体 / perinuclear region of cytoplasm / negative regulation of transcription by RNA polymerase II / positive regulation of transcription by RNA polymerase II / 核小体 / perinuclear region of cytoplasm / negative regulation of transcription by RNA polymerase II / positive regulation of transcription by RNA polymerase II /  ミトコンドリア / zinc ion binding / ミトコンドリア / zinc ion binding /  細胞核 / 細胞核 /  細胞膜 / 細胞膜 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 1.76 Å 分子置換 / 解像度: 1.76 Å | |||||||||
 データ登録者 データ登録者 | Rumpf, T. / Gerhardt, S. / Einsle, O. / Jung, M. | |||||||||
| 資金援助 |  ドイツ, 2件 ドイツ, 2件
| |||||||||
 引用 引用 |  ジャーナル: Acta Crystallogr.,Sect.F / 年: 2015 ジャーナル: Acta Crystallogr.,Sect.F / 年: 2015タイトル: Seeding for sirtuins: microseed matrix seeding to obtain crystals of human Sirt3 and Sirt2 suitable for soaking. 著者: Rumpf, T. / Gerhardt, S. / Einsle, O. / Jung, M. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  5d7p.cif.gz 5d7p.cif.gz | 258.3 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb5d7p.ent.gz pdb5d7p.ent.gz | 206.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  5d7p.json.gz 5d7p.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/d7/5d7p https://data.pdbj.org/pub/pdb/validation_reports/d7/5d7p ftp://data.pdbj.org/pub/pdb/validation_reports/d7/5d7p ftp://data.pdbj.org/pub/pdb/validation_reports/d7/5d7p | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 1種, 2分子 AB
| #1: タンパク質 | 分子量: 34416.727 Da / 分子数: 2 / 断片: UNP residues 56-356 / 由来タイプ: 組換発現 詳細: Gly1 originates from TEV cleavage site His2/Met3 originate from NdeI restriction site of the vector 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: SIRT2, SIR2L, SIR2L2 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: SIRT2, SIR2L, SIR2L2 / 発現宿主:   Escherichia coli (大腸菌) Escherichia coli (大腸菌)参照: UniProt: Q8IXJ6,  加水分解酵素; ペプチド以外のCN結合加水分解酵素; 鎖状アミドに作用 加水分解酵素; ペプチド以外のCN結合加水分解酵素; 鎖状アミドに作用 |
|---|
-非ポリマー , 5種, 298分子 
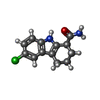






| #2: 化合物 | | #3: 化合物 | #4: 化合物 | ChemComp-OCZ / ( #5: 化合物 | ChemComp-PEG / |  ジエチレングリコール ジエチレングリコール#6: 水 | ChemComp-HOH / |  水 水 |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 X線回折 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.46 Å3/Da / 溶媒含有率: 50.03 % |
|---|---|
結晶化 | 温度: 293 K / 手法: 蒸気拡散法, シッティングドロップ法 / pH: 5.75 / 詳細: 18 % (w/v) PEG 10000, 0.1 M Bis-Tris / PH範囲: 5.75 |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU MICROMAX-007 HF / 波長: 1.5418 Å 回転陽極 / タイプ: RIGAKU MICROMAX-007 HF / 波長: 1.5418 Å |
| 検出器 | タイプ: MAR scanner 345 mm plate / 検出器: IMAGE PLATE / 日付: 2013年7月12日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長 : 1.5418 Å / 相対比: 1 : 1.5418 Å / 相対比: 1 |
| 反射 | 解像度: 1.76→39.41 Å / Num. obs: 66454 / % possible obs: 97.8 % / 冗長度: 14.3 % / Rmerge(I) obs: 0.08 / Net I/σ(I): 18.9 |
| 反射 シェル | 解像度: 1.76→1.79 Å / Rmerge(I) obs: 1.136 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  分子置換 分子置換開始モデル: 5D7O 解像度: 1.76→39.41 Å / Cor.coef. Fo:Fc: 0.961 / Cor.coef. Fo:Fc free: 0.947 / SU B: 5.259 / SU ML: 0.09 / 交差検証法: THROUGHOUT / ESU R: 0.121 / ESU R Free: 0.117 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: HYDROGENS HAVE BEEN ADDED IN THE RIDING POSITIONS
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.2 Å / 溶媒モデル: MASK | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 34.863 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: 1 / 解像度: 1.76→39.41 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー
















 PDBj
PDBj





