+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 3ucy | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Structure of Mg2+ bound N-terminal domain of calmodulin in the presence of Zn2+ | ||||||
 要素 要素 | Calmodulin カルモジュリン カルモジュリン | ||||||
 キーワード キーワード |  CALCIUM-BINDING PROTEIN (カルシウム結合タンパク質) / CALCIUM-BINDING PROTEIN (カルシウム結合タンパク質) /  EF-HAND (EFハンド) / EF-HAND (EFハンド) /  METAL BINDING (金属) / METAL BINDING (金属) /  CALCIUM REGULATION CALCIUM REGULATION | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 : / establishment of protein localization to mitochondrial membrane / type 3 metabotropic glutamate receptor binding / : / establishment of protein localization to mitochondrial membrane / type 3 metabotropic glutamate receptor binding /  CAM型光合成 / Cam-PDE 1 activation / Sodium/Calcium exchangers / Calmodulin induced events / Reduction of cytosolic Ca++ levels / Activation of Ca-permeable Kainate Receptor / CREB1 phosphorylation through the activation of CaMKII/CaMKK/CaMKIV cascasde ... CAM型光合成 / Cam-PDE 1 activation / Sodium/Calcium exchangers / Calmodulin induced events / Reduction of cytosolic Ca++ levels / Activation of Ca-permeable Kainate Receptor / CREB1 phosphorylation through the activation of CaMKII/CaMKK/CaMKIV cascasde ... : / establishment of protein localization to mitochondrial membrane / type 3 metabotropic glutamate receptor binding / : / establishment of protein localization to mitochondrial membrane / type 3 metabotropic glutamate receptor binding /  CAM型光合成 / Cam-PDE 1 activation / Sodium/Calcium exchangers / Calmodulin induced events / Reduction of cytosolic Ca++ levels / Activation of Ca-permeable Kainate Receptor / CREB1 phosphorylation through the activation of CaMKII/CaMKK/CaMKIV cascasde / regulation of synaptic vesicle endocytosis / Loss of phosphorylation of MECP2 at T308 / CREB1 phosphorylation through the activation of Adenylate Cyclase / PKA activation / negative regulation of high voltage-gated calcium channel activity / regulation of synaptic vesicle exocytosis / CaMK IV-mediated phosphorylation of CREB / Glycogen breakdown (glycogenolysis) / negative regulation of calcium ion export across plasma membrane / organelle localization by membrane tethering / Activation of RAC1 downstream of NMDARs / regulation of cardiac muscle cell action potential / mitochondrion-endoplasmic reticulum membrane tethering / CLEC7A (Dectin-1) induces NFAT activation / autophagosome membrane docking / response to corticosterone / positive regulation of ryanodine-sensitive calcium-release channel activity / Negative regulation of NMDA receptor-mediated neuronal transmission / CAM型光合成 / Cam-PDE 1 activation / Sodium/Calcium exchangers / Calmodulin induced events / Reduction of cytosolic Ca++ levels / Activation of Ca-permeable Kainate Receptor / CREB1 phosphorylation through the activation of CaMKII/CaMKK/CaMKIV cascasde / regulation of synaptic vesicle endocytosis / Loss of phosphorylation of MECP2 at T308 / CREB1 phosphorylation through the activation of Adenylate Cyclase / PKA activation / negative regulation of high voltage-gated calcium channel activity / regulation of synaptic vesicle exocytosis / CaMK IV-mediated phosphorylation of CREB / Glycogen breakdown (glycogenolysis) / negative regulation of calcium ion export across plasma membrane / organelle localization by membrane tethering / Activation of RAC1 downstream of NMDARs / regulation of cardiac muscle cell action potential / mitochondrion-endoplasmic reticulum membrane tethering / CLEC7A (Dectin-1) induces NFAT activation / autophagosome membrane docking / response to corticosterone / positive regulation of ryanodine-sensitive calcium-release channel activity / Negative regulation of NMDA receptor-mediated neuronal transmission /  nitric-oxide synthase binding / regulation of cell communication by electrical coupling involved in cardiac conduction / Unblocking of NMDA receptors, glutamate binding and activation / negative regulation of peptidyl-threonine phosphorylation / Synthesis of IP3 and IP4 in the cytosol / Phase 0 - rapid depolarisation / protein phosphatase activator activity / RHO GTPases activate PAKs / positive regulation of cyclic-nucleotide phosphodiesterase activity / positive regulation of phosphoprotein phosphatase activity / nitric-oxide synthase binding / regulation of cell communication by electrical coupling involved in cardiac conduction / Unblocking of NMDA receptors, glutamate binding and activation / negative regulation of peptidyl-threonine phosphorylation / Synthesis of IP3 and IP4 in the cytosol / Phase 0 - rapid depolarisation / protein phosphatase activator activity / RHO GTPases activate PAKs / positive regulation of cyclic-nucleotide phosphodiesterase activity / positive regulation of phosphoprotein phosphatase activity /  長期増強 / Ion transport by P-type ATPases / Uptake and function of anthrax toxins / 長期増強 / Ion transport by P-type ATPases / Uptake and function of anthrax toxins /  adenylate cyclase binding / Calcineurin activates NFAT / Regulation of MECP2 expression and activity / adenylate cyclase binding / Calcineurin activates NFAT / Regulation of MECP2 expression and activity /  catalytic complex / DARPP-32 events / detection of calcium ion / negative regulation of ryanodine-sensitive calcium-release channel activity / Smooth Muscle Contraction / RHO GTPases activate IQGAPs / regulation of cardiac muscle contraction / calcium channel inhibitor activity / cellular response to interferon-beta / positive regulation of DNA binding / regulation of cardiac muscle contraction by regulation of the release of sequestered calcium ion / catalytic complex / DARPP-32 events / detection of calcium ion / negative regulation of ryanodine-sensitive calcium-release channel activity / Smooth Muscle Contraction / RHO GTPases activate IQGAPs / regulation of cardiac muscle contraction / calcium channel inhibitor activity / cellular response to interferon-beta / positive regulation of DNA binding / regulation of cardiac muscle contraction by regulation of the release of sequestered calcium ion /  Protein methylation / enzyme regulator activity / Protein methylation / enzyme regulator activity /  voltage-gated potassium channel complex / voltage-gated potassium channel complex /  phosphatidylinositol 3-kinase binding / Activation of AMPK downstream of NMDARs / eNOS activation / regulation of release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / regulation of calcium-mediated signaling / positive regulation of protein dephosphorylation / phosphatidylinositol 3-kinase binding / Activation of AMPK downstream of NMDARs / eNOS activation / regulation of release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / regulation of calcium-mediated signaling / positive regulation of protein dephosphorylation /  titin binding / regulation of ryanodine-sensitive calcium-release channel activity / Tetrahydrobiopterin (BH4) synthesis, recycling, salvage and regulation / Ion homeostasis / positive regulation of protein autophosphorylation / sperm midpiece / response to amphetamine / titin binding / regulation of ryanodine-sensitive calcium-release channel activity / Tetrahydrobiopterin (BH4) synthesis, recycling, salvage and regulation / Ion homeostasis / positive regulation of protein autophosphorylation / sperm midpiece / response to amphetamine /  calcium channel complex / activation of adenylate cyclase activity / substantia nigra development / adenylate cyclase activator activity / Ras activation upon Ca2+ influx through NMDA receptor / calcium channel complex / activation of adenylate cyclase activity / substantia nigra development / adenylate cyclase activator activity / Ras activation upon Ca2+ influx through NMDA receptor /  regulation of heart rate / nitric-oxide synthase regulator activity / protein serine/threonine kinase activator activity / regulation of heart rate / nitric-oxide synthase regulator activity / protein serine/threonine kinase activator activity /  sarcomere / FCERI mediated Ca+2 mobilization / FCGR3A-mediated IL10 synthesis / VEGFR2 mediated vascular permeability / positive regulation of peptidyl-threonine phosphorylation / Antigen activates B Cell Receptor (BCR) leading to generation of second messengers / VEGFR2 mediated cell proliferation / sarcomere / FCERI mediated Ca+2 mobilization / FCGR3A-mediated IL10 synthesis / VEGFR2 mediated vascular permeability / positive regulation of peptidyl-threonine phosphorylation / Antigen activates B Cell Receptor (BCR) leading to generation of second messengers / VEGFR2 mediated cell proliferation /  regulation of cytokinesis / positive regulation of nitric-oxide synthase activity / Translocation of SLC2A4 (GLUT4) to the plasma membrane / spindle microtubule / regulation of cytokinesis / positive regulation of nitric-oxide synthase activity / Translocation of SLC2A4 (GLUT4) to the plasma membrane / spindle microtubule /  ミトコンドリア / RAF activation / positive regulation of receptor signaling pathway via JAK-STAT / positive regulation of protein serine/threonine kinase activity / Transcriptional activation of mitochondrial biogenesis / Stimuli-sensing channels / synaptic vesicle membrane / ミトコンドリア / RAF activation / positive regulation of receptor signaling pathway via JAK-STAT / positive regulation of protein serine/threonine kinase activity / Transcriptional activation of mitochondrial biogenesis / Stimuli-sensing channels / synaptic vesicle membrane /  紡錘体 / cellular response to type II interferon / response to calcium ion 紡錘体 / cellular response to type II interferon / response to calcium ion類似検索 - 分子機能 | ||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  単波長異常分散 / 解像度: 1.8 Å 単波長異常分散 / 解像度: 1.8 Å | ||||||
 データ登録者 データ登録者 | Senguen, F.T. / Grabarek, Z. | ||||||
 引用 引用 |  ジャーナル: Biochemistry / 年: 2012 ジャーナル: Biochemistry / 年: 2012タイトル: X-ray Structures of Magnesium and Manganese Complexes with the N-Terminal Domain of Calmodulin: Insights into the Mechanism and Specificity of Metal Ion Binding to an EF-Hand. 著者: Senguen, F.T. / Grabarek, Z. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  3ucy.cif.gz 3ucy.cif.gz | 30.5 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb3ucy.ent.gz pdb3ucy.ent.gz | 19.9 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  3ucy.json.gz 3ucy.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/uc/3ucy https://data.pdbj.org/pub/pdb/validation_reports/uc/3ucy ftp://data.pdbj.org/pub/pdb/validation_reports/uc/3ucy ftp://data.pdbj.org/pub/pdb/validation_reports/uc/3ucy | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 1種, 1分子 A
| #1: タンパク質 |  カルモジュリン / CaM カルモジュリン / CaM分子量: 8799.724 Da / 分子数: 1 / 断片: N-terminal domain residues 2-80 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) Homo sapiens (ヒト)遺伝子: CALM, CALM1, CALM2, CALM3, CALML2, CAM, CAM1, CAM2, CAM3, CAMB, CAMC, CAMIII プラスミド: PAED4 / 発現宿主:   Escherichia coli (大腸菌) / 株 (発現宿主): BL21 / 参照: UniProt: P62158, UniProt: P0DP23*PLUS Escherichia coli (大腸菌) / 株 (発現宿主): BL21 / 参照: UniProt: P62158, UniProt: P0DP23*PLUS |
|---|
-非ポリマー , 5種, 73分子 


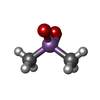





| #2: 化合物 | ChemComp-NA / | ||||
|---|---|---|---|---|---|
| #3: 化合物 | ChemComp-MG / | ||||
| #4: 化合物 | | #5: 化合物 | ChemComp-CAC / |  カコジル酸 カコジル酸#6: 水 | ChemComp-HOH / |  水 水 |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.53 Å3/Da / 溶媒含有率: 51.38 % |
|---|---|
結晶化 | 温度: 298 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 6.5 詳細: 100MM TRIS CACODYLATE, 25MM ZNCL2, 16% PEG8000, 100MM MGCL2, 20% ETHYLENE GLYCOL, pH 6.5, VAPOR DIFFUSION, HANGING DROP, temperature 298K |
-データ収集
| 回折 | 平均測定温度: 100 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  NSLS NSLS  / ビームライン: X29A / 波長: 1.075 Å / ビームライン: X29A / 波長: 1.075 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 検出器 | タイプ: ADSC QUANTUM 315r / 検出器: CCD / 日付: 2011年7月20日 / 詳細: NINE QUADRANT | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射 | モノクロメーター: SI(111) / プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射波長 | 波長 : 1.075 Å / 相対比: 1 : 1.075 Å / 相対比: 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reflection | 冗長度: 27.4 % / Av σ(I) over netI: 18.29 / 数: 251118 / Rmerge(I) obs: 0.157 / Χ2: 1.33 / D res high: 1.8 Å / D res low: 50 Å / Num. obs: 9179 / % possible obs: 100 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diffraction reflection shell |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 | 解像度: 1.8→50 Å / Num. obs: 9179 / % possible obs: 100 % / Observed criterion σ(I): 2 / 冗長度: 27.4 % / Biso Wilson estimate: 31.869 Å2 / Rmerge(I) obs: 0.157 / Χ2: 1.325 / Net I/σ(I): 12.9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 シェル |
|
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  単波長異常分散 / 解像度: 1.8→35.73 Å / Cor.coef. Fo:Fc: 0.963 / Cor.coef. Fo:Fc free: 0.965 / Occupancy max: 1 / Occupancy min: 0.1 / SU B: 3.259 / SU ML: 0.095 / 交差検証法: THROUGHOUT / σ(F): 0 / ESU R Free: 0.117 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD 単波長異常分散 / 解像度: 1.8→35.73 Å / Cor.coef. Fo:Fc: 0.963 / Cor.coef. Fo:Fc free: 0.965 / Occupancy max: 1 / Occupancy min: 0.1 / SU B: 3.259 / SU ML: 0.095 / 交差検証法: THROUGHOUT / σ(F): 0 / ESU R Free: 0.117 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD詳細: HYDROGENS HAVE BEEN USED IF PRESENT IN THE INPUT U VALUES: REFINED INDIVIDUALLY
| |||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.2 Å / 溶媒モデル: MASK | |||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 79.96 Å2 / Biso mean: 38.4893 Å2 / Biso min: 23.14 Å2
| |||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.8→35.73 Å
| |||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 1.8→1.844 Å / Total num. of bins used: 20
|
 ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj