[日本語] English
 万見
万見- EMDB-13393: The structure of human neurofibromin isoform 2 in closed conformation -
+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-13393 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | The structure of human neurofibromin isoform 2 in closed conformation | ||||||||||||
 マップデータ マップデータ | DeepEMhancer sharpened map. Main map. | ||||||||||||
 試料 試料 |
| ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of mast cell apoptotic process / negative regulation of Rac protein signal transduction / regulation of glial cell differentiation / gamma-aminobutyric acid secretion, neurotransmission /  observational learning / Schwann cell migration / negative regulation of Schwann cell migration / vascular associated smooth muscle cell migration / amygdala development / mast cell apoptotic process ...positive regulation of mast cell apoptotic process / negative regulation of Rac protein signal transduction / regulation of glial cell differentiation / gamma-aminobutyric acid secretion, neurotransmission / observational learning / Schwann cell migration / negative regulation of Schwann cell migration / vascular associated smooth muscle cell migration / amygdala development / mast cell apoptotic process ...positive regulation of mast cell apoptotic process / negative regulation of Rac protein signal transduction / regulation of glial cell differentiation / gamma-aminobutyric acid secretion, neurotransmission /  observational learning / Schwann cell migration / negative regulation of Schwann cell migration / vascular associated smooth muscle cell migration / amygdala development / mast cell apoptotic process / negative regulation of mast cell proliferation / Schwann cell proliferation / vascular associated smooth muscle cell proliferation / mast cell proliferation / glutamate secretion, neurotransmission / negative regulation of Schwann cell proliferation / negative regulation of leukocyte migration / negative regulation of vascular associated smooth muscle cell migration / positive regulation of adenylate cyclase activity / regulation of cell-matrix adhesion / forebrain morphogenesis / negative regulation of neurotransmitter secretion / hair follicle maturation / regulation of blood vessel endothelial cell migration / observational learning / Schwann cell migration / negative regulation of Schwann cell migration / vascular associated smooth muscle cell migration / amygdala development / mast cell apoptotic process / negative regulation of mast cell proliferation / Schwann cell proliferation / vascular associated smooth muscle cell proliferation / mast cell proliferation / glutamate secretion, neurotransmission / negative regulation of Schwann cell proliferation / negative regulation of leukocyte migration / negative regulation of vascular associated smooth muscle cell migration / positive regulation of adenylate cyclase activity / regulation of cell-matrix adhesion / forebrain morphogenesis / negative regulation of neurotransmitter secretion / hair follicle maturation / regulation of blood vessel endothelial cell migration /  cell communication / smooth muscle tissue development / negative regulation of oligodendrocyte differentiation / camera-type eye morphogenesis / cell communication / smooth muscle tissue development / negative regulation of oligodendrocyte differentiation / camera-type eye morphogenesis /  sympathetic nervous system development / sympathetic nervous system development /  myelination in peripheral nervous system / myeloid leukocyte migration / myelination in peripheral nervous system / myeloid leukocyte migration /  phosphatidylethanolamine binding / phosphatidylethanolamine binding /  phosphatidylcholine binding / phosphatidylcholine binding /  peripheral nervous system development / metanephros development / positive regulation of extrinsic apoptotic signaling pathway in absence of ligand / collagen fibril organization / endothelial cell proliferation / peripheral nervous system development / metanephros development / positive regulation of extrinsic apoptotic signaling pathway in absence of ligand / collagen fibril organization / endothelial cell proliferation /  regulation of bone resorption / regulation of long-term synaptic potentiation / neural tube development / forebrain astrocyte development / regulation of postsynapse organization / regulation of bone resorption / regulation of long-term synaptic potentiation / neural tube development / forebrain astrocyte development / regulation of postsynapse organization /  顔料 / artery morphogenesis / negative regulation of neuroblast proliferation / 顔料 / artery morphogenesis / negative regulation of neuroblast proliferation /  regulation of synaptic transmission, GABAergic / adrenal gland development / negative regulation of protein import into nucleus / negative regulation of cell-matrix adhesion / spinal cord development / regulation of synaptic transmission, GABAergic / adrenal gland development / negative regulation of protein import into nucleus / negative regulation of cell-matrix adhesion / spinal cord development /  regulation of GTPase activity / negative regulation of MAPK cascade / Rac protein signal transduction / oligodendrocyte differentiation / negative regulation of osteoclast differentiation / negative regulation of endothelial cell proliferation / RAS signaling downstream of NF1 loss-of-function variants / negative regulation of astrocyte differentiation / neuroblast proliferation / extrinsic apoptotic signaling pathway via death domain receptors / regulation of GTPase activity / negative regulation of MAPK cascade / Rac protein signal transduction / oligodendrocyte differentiation / negative regulation of osteoclast differentiation / negative regulation of endothelial cell proliferation / RAS signaling downstream of NF1 loss-of-function variants / negative regulation of astrocyte differentiation / neuroblast proliferation / extrinsic apoptotic signaling pathway via death domain receptors /  regulation of angiogenesis / Schwann cell development / negative regulation of stem cell proliferation / negative regulation of fibroblast proliferation / skeletal muscle tissue development / extrinsic apoptotic signaling pathway in absence of ligand / positive regulation of vascular associated smooth muscle cell proliferation / positive regulation of endothelial cell proliferation / regulation of angiogenesis / Schwann cell development / negative regulation of stem cell proliferation / negative regulation of fibroblast proliferation / skeletal muscle tissue development / extrinsic apoptotic signaling pathway in absence of ligand / positive regulation of vascular associated smooth muscle cell proliferation / positive regulation of endothelial cell proliferation /  GTPase activator activity / extracellular matrix organization / negative regulation of angiogenesis / osteoclast differentiation / regulation of ERK1 and ERK2 cascade / negative regulation of cell migration / liver development / negative regulation of MAP kinase activity / phosphatidylinositol 3-kinase/protein kinase B signal transduction / long-term synaptic potentiation / stem cell proliferation / regulation of long-term neuronal synaptic plasticity / GTPase activator activity / extracellular matrix organization / negative regulation of angiogenesis / osteoclast differentiation / regulation of ERK1 and ERK2 cascade / negative regulation of cell migration / liver development / negative regulation of MAP kinase activity / phosphatidylinositol 3-kinase/protein kinase B signal transduction / long-term synaptic potentiation / stem cell proliferation / regulation of long-term neuronal synaptic plasticity /  brain development / negative regulation of protein kinase activity / brain development / negative regulation of protein kinase activity /  visual learning / visual learning /  wound healing / cerebral cortex development / wound healing / cerebral cortex development /  認識 / osteoblast differentiation / positive regulation of GTPase activity / Regulation of RAS by GAPs / protein import into nucleus / positive regulation of neuron apoptotic process / 認識 / osteoblast differentiation / positive regulation of GTPase activity / Regulation of RAS by GAPs / protein import into nucleus / positive regulation of neuron apoptotic process /  分裂促進因子活性化タンパク質キナーゼ / presynapse / cellular response to heat / 分裂促進因子活性化タンパク質キナーゼ / presynapse / cellular response to heat /  heart development / fibroblast proliferation / actin cytoskeleton organization / heart development / fibroblast proliferation / actin cytoskeleton organization /  遺伝子発現の調節 / 遺伝子発現の調節 /  血管新生 血管新生類似検索 - 分子機能 | ||||||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
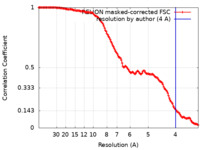
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 4.0 Å クライオ電子顕微鏡法 / 解像度: 4.0 Å | ||||||||||||
 データ登録者 データ登録者 | Naschberger A / Baradaran R / Carroni M / Rupp B | ||||||||||||
| 資金援助 |  オーストリア, 3件 オーストリア, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2021 ジャーナル: Nature / 年: 2021タイトル: The structure of neurofibromin isoform 2 reveals different functional states. 著者: Andreas Naschberger / Rozbeh Baradaran / Bernhard Rupp / Marta Carroni /    要旨: The autosomal dominant monogenetic disease neurofibromatosis type 1 (NF1) affects approximately one in 3,000 individuals and is caused by mutations in the NF1 tumour suppressor gene, leading to ...The autosomal dominant monogenetic disease neurofibromatosis type 1 (NF1) affects approximately one in 3,000 individuals and is caused by mutations in the NF1 tumour suppressor gene, leading to dysfunction in the protein neurofibromin (Nf1). As a GTPase-activating protein, a key function of Nf1 is repression of the Ras oncogene signalling cascade. We determined the human Nf1 dimer structure at an overall resolution of 3.3 Å. The cryo-electron microscopy structure reveals domain organization and structural details of the Nf1 exon 23a splicing isoform 2 in a closed, self-inhibited, Zn-stabilized state and an open state. In the closed conformation, HEAT/ARM core domains shield the GTPase-activating protein-related domain (GRD) so that Ras binding is sterically inhibited. In a distinctly different, open conformation of one protomer, a large-scale movement of the GRD occurs, which is necessary to access Ras, whereas Sec14-PH reorients to allow interaction with the cellular membrane. Zn incubation of Nf1 leads to reduced Ras-GAP activity with both protomers in the self-inhibited, closed conformation stabilized by a Zn binding site between the N-HEAT/ARM domain and the GRD-Sec14-PH linker. The transition between closed, self-inhibited states of Nf1 and open states provides guidance for targeted studies deciphering the complex molecular mechanism behind the widespread neurofibromatosis syndrome and Nf1 dysfunction in carcinogenesis. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_13393.map.gz emd_13393.map.gz | 349.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-13393-v30.xml emd-13393-v30.xml emd-13393.xml emd-13393.xml | 18.9 KB 18.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_13393_fsc.xml emd_13393_fsc.xml | 14.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_13393.png emd_13393.png | 58.5 KB | ||
| マスクデータ |  emd_13393_msk_1.map emd_13393_msk_1.map | 244.1 MB |  マスクマップ マスクマップ | |
| その他 |  emd_13393_additional_1.map.gz emd_13393_additional_1.map.gz emd_13393_half_map_1.map.gz emd_13393_half_map_1.map.gz emd_13393_half_map_2.map.gz emd_13393_half_map_2.map.gz | 206.5 MB 194.9 MB 195.1 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-13393 http://ftp.pdbj.org/pub/emdb/structures/EMD-13393 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-13393 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-13393 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_13393.map.gz / 形式: CCP4 / 大きさ: 396.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_13393.map.gz / 形式: CCP4 / 大きさ: 396.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | DeepEMhancer sharpened map. Main map. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.4638 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_13393_msk_1.map emd_13393_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: Local resolution filtered map.
| ファイル | emd_13393_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Local resolution filtered map. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_13393_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_13393_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Homo-dimer of human Neurofibromin Isoform 2
| 全体 | 名称: Homo-dimer of human Neurofibromin Isoform 2 |
|---|---|
| 要素 |
|
-超分子 #1: Homo-dimer of human Neurofibromin Isoform 2
| 超分子 | 名称: Homo-dimer of human Neurofibromin Isoform 2 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ) |
| 分子量 | 実験値: 640 KDa |
-分子 #1: Neurofibromin
| 分子 | 名称: Neurofibromin / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 319.757656 KDa |
| 組換発現 | 生物種:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ) |
| 配列 | 文字列: MAAHRPVEWV QAVVSRFDEQ LPIKTGQQNT HTKVSTEHNK ECLINISKYK FSLVISGLTT ILKNVNNMRI FGEAAEKNLY LSQLIILDT LEKCLAGQPK DTMRLDETML VKQLLPEICH FLHTCREGNQ HAAELRNSAS GVLFSLSCNN FNAVFSRIST R LQELTVCS ...文字列: MAAHRPVEWV QAVVSRFDEQ LPIKTGQQNT HTKVSTEHNK ECLINISKYK FSLVISGLTT ILKNVNNMRI FGEAAEKNLY LSQLIILDT LEKCLAGQPK DTMRLDETML VKQLLPEICH FLHTCREGNQ HAAELRNSAS GVLFSLSCNN FNAVFSRIST R LQELTVCS EDNVDVHDIE LLQYINVDCA KLKRLLKETA FKFKALKKVA QLAVINSLEK AFWNWVENYP DEFTKLYQIP QT DMAECAE KLFDLVDGFA ESTKRKAAVW PLQIILLILC PEIIQDISKD VVDENNMNKK LFLDSLRKAL AGHGGSRQLT ESA AIACVK LCKASTYINW EDNSVIFLLV QSMVVDLKNL LFNPSKPFSR GSQPADVDLM IDCLVSCFRI SPHNNQHFKI CLAQ NSPST FHYVLVNSLH RIITNSALDW WPKIDAVYCH SVELRNMFGE TLHKAVQGCG AHPAIRMAPS LTFKEKVTSL KFKEK PTDL ETRSYKYLLL SMVKLIHADP KLLLCNPRKQ GPETQGSTAE LITGLVQLVP QSHMPEIAQE AMEALLVLHQ LDSIDL WNP DAPVETFWEI SSQMLFYICK KLTSHQMLSS TEILKWLREI LICRNKFLLK NKQADRSSCH FLLFYGVGCD IPSSGNT SQ MSMDHEELLR TPGASLRKGK GNSSMDSAAG CSGTPPICRQ AQTKLEVALY MFLWNPDTEA VLVAMSCFRH LCEEADIR C GVDEVSVHNL LPNYNTFMEF ASVSNMMSTG RAALQKRVMA LLRRIEHPTA GNTEAWEDTH AKWEQATKLI LNYPKAKME DGQAAESLHK TIVKRRMSHV SGGGSIDLSD TDSLQEWINM TGFLCALGGV CLQQRSNSGL ATYSPPMGPV SERKGSMISV MSSEGNADT PVSKFMDRLL SLMVCNHEKV GLQIRTNVKD LVGLELSPAL YPMLFNKLKN TISKFFDSQG QVLLTDTNTQ F VEQTIAIM KNLLDNHTEG SSEHLGQASI ETMMLNLVRY VRVLGNMVHA IQIKTKLCQL VEVMMARRDD LSFCQEMKFR NK MVEYLTD WVMGTSNQAA DDDVKCLTRD LDQASMEAVV SLLAGLPLQP EEGDGVELME AKSQLFLKYF TLFMNLLNDC SEV EDESAQ TGGRKRGMSR RLASLRHCTV LAMSNLLNAN VDSGLMHSIG LGYHKDLQTR ATFMEVLTKI LQQGTEFDTL AETV LADRF ERLVELVTMM GDQGELPIAM ALANVVPCSQ WDELARVLVT LFDSRHLLYQ LLWNMFSKEV ELADSMQTLF RGNSL ASKI MTFCFKVYGA TYLQKLLDPL LRIVITSSDW QHVSFEVDPT RLEPSESLEE NQRNLLQMTE KFFHAIISSS SEFPPQ LRS VCHCLYQATC HSLLNKATVK EKKENKKSVV SQRFPQNSIG AVGSAMFLRF INPAIVSPYE AGILDKKPPP RIERGLK LM SKILQSIANH VLFTKEEHMR PFNDFVKSNF DAARRFFLDI ASDCPTSDAV NHSLSFISDG NVLALHRLLW NNQEKIGQ Y LSSNRDHKAV GRRPFDKMAT LLAYLGPPEH KPVADTHWSS LNLTSSKFEE FMTRHQVHEK EEFKALKTLS IFYQAGTSK AGNPIFYYVA RRFKTGQING DLLIYHVLLT LKPYYAKPYE IVVDLTHTGP SNRFKTDFLS KWFVVFPGFA YDNVSAVYIY NCNSWVREY TKYHERLLTG LKGSKRLVFI DCPGKLAEHI EHEQQKLPAA TLALEEDLKV FHNALKLAHK DTKVSIKVGS T AVQVTSAE RTKVLGQSVF LNDIYYASEI EEICLVDENQ FTLTIANQGT PLTFMHQECE AIVQSIIHIR TRWELSQPDS IP QHTKIRP KDVPGTLLNI ALLNLGSSDP SLRSAAYNLL CALTCTFNLK IEGQLLETSG LCIPANNTLF IVSISKTLAA NEP HLTLEF LEECISGFSK SSIELKHLCL EYMTPWLSNL VRFCKHNDDA KRQRVTAILD KLITMTINEK QMYPSIQAKI WGSL GQITD LLDVVLDSFI KTSATGGLGS IKAEVMADTA VALASGNVKL VSSKVIGRMC KIIDKTCLSP TPTLEQHLMW DDIAI LARY MLMLSFNNSL DVAAHLPYLF HVVTFLVATG PLSLRASTHG LVINIIHSLC TCSQLHFSEE TKQVLRLSLT EFSLPK FYL LFGISKVKSA AVIAFRSSYR DRSFSPGSYE RETFALTSLE TVTEALLEIM EACMRDIPTC KWLDQWTELA QRFAFQY NP SLQPRALVVF GCISKRVSHG QIKQIIRILS KALESCLKGP DTYNSQVLIE ATVIALTKLQ PLLNKDSPLH KALFWVAV A VLQLDEVNLY SAGTALLEQN LHTLDSLRIF NDKSPEEVFM AIRNPLEWHC KQMDHFVGLN FNSNFNFALV GHLLKGYRH PSPAIVARTV RILHTLLTLV NKHRNCDKFE VNTQSVAYLA ALLTVSEEVR SRCSLKHRKS LLLTDISMEN VPMDTYPIHH GDPSYRTLK ETQPWSSPKG SEGYLAATYP TVGQTSPRAR KSMSLDMGQP SQANTKKLLG TRKSFDHLIS DTKAPKRQEM E SGITTPPK MRRVAETDYE METQRISSSQ QHPHLRKVSV SESNVLLDEE VLTDPKIQAL LLTVLATLVK YTTDEFDQRI LY EYLAEAS VVFPKVFPVV HNLLDSKINT LLSLCQDPNL LNPIHGIVQS VVYHEESPPQ YQTSYLQSFG FNGLWRFAGP FSK QTQIPD YAELIVKFLD ALIDTYLPGI DEETSEESLL TPTSPYPPAL QSQLSITANL NLSNSMTSLA TSQHSPGIDK ENVE LSPTT GHCNSGRTRH GSASQVQKQR SAGSFKRNSI KKIV |
-分子 #2: ZINC ION
| 分子 | 名称: ZINC ION / タイプ: ligand / ID: 2 / コピー数: 2 / 式: ZN |
|---|---|
| 分子量 | 理論値: 65.409 Da |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: OTHER / 撮影モード: BRIGHT FIELD Bright-field microscopy Bright-field microscopy |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 1.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー
























 Z
Z Y
Y X
X