+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
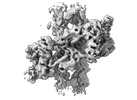
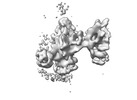
| タイトル | Local Refinement of the C-terminal Half of Leucine Rich Repeat Kinase 2 (LRRK2) (I2020T) tetramer bound to 11-protofilament microtubule in presence of MLi-2 kinase inhibitor | |||||||||
 マップデータ マップデータ | Local refinement of LRRK2RCKW tetramer bound to 11-pf microtubule with MLi-2 present. Focused on the tetramer only. Sharpened. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  parkinson's disease (パーキンソン病) / parkinson's disease (パーキンソン病) /  microtubule (微小管) / microtubule (微小管) /  kinase (キナーゼ) / kinase (キナーゼ) /  gtpase (GTPアーゼ) / gtpase (GTPアーゼ) /  CYTOSOLIC PROTEIN (細胞質基質) CYTOSOLIC PROTEIN (細胞質基質) | |||||||||
| 生物種 |   Homo sapiens (ヒト) / Homo sapiens (ヒト) /   Bos taurus (ウシ) Bos taurus (ウシ) | |||||||||
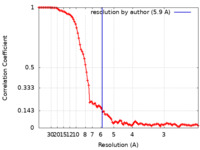
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 5.9 Å クライオ電子顕微鏡法 / 解像度: 5.9 Å | |||||||||
 データ登録者 データ登録者 | Matyszewski M / Leschziner AE | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2022 ジャーナル: Nat Struct Mol Biol / 年: 2022タイトル: Structural basis for Parkinson's disease-linked LRRK2's binding to microtubules. 著者: David M Snead / Mariusz Matyszewski / Andrea M Dickey / Yu Xuan Lin / Andres E Leschziner / Samara L Reck-Peterson /  要旨: Leucine-rich repeat kinase 2 (LRRK2) is one of the most commonly mutated genes in familial Parkinson's disease (PD). Under some circumstances, LRRK2 co-localizes with microtubules in cells, an ...Leucine-rich repeat kinase 2 (LRRK2) is one of the most commonly mutated genes in familial Parkinson's disease (PD). Under some circumstances, LRRK2 co-localizes with microtubules in cells, an association enhanced by PD mutations. We report a cryo-EM structure of the catalytic half of LRRK2, containing its kinase, in a closed conformation, and GTPase domains, bound to microtubules. We also report a structure of the catalytic half of LRRK1, which is closely related to LRRK2 but is not linked to PD. Although LRRK1's structure is similar to that of LRRK2, we find that LRRK1 does not interact with microtubules. Guided by these structures, we identify amino acids in LRRK2's GTPase that mediate microtubule binding; mutating them disrupts microtubule binding in vitro and in cells, without affecting LRRK2's kinase activity. Our results have implications for the design of therapeutic LRRK2 kinase inhibitors. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_25664.map.gz emd_25664.map.gz | 97.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-25664-v30.xml emd-25664-v30.xml emd-25664.xml emd-25664.xml | 23.2 KB 23.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_25664_fsc.xml emd_25664_fsc.xml | 10.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_25664.png emd_25664.png | 58 KB | ||
| マスクデータ |  emd_25664_msk_1.map emd_25664_msk_1.map | 103 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-25664.cif.gz emd-25664.cif.gz | 7.3 KB | ||
| その他 |  emd_25664_additional_1.map.gz emd_25664_additional_1.map.gz emd_25664_half_map_1.map.gz emd_25664_half_map_1.map.gz emd_25664_half_map_2.map.gz emd_25664_half_map_2.map.gz | 50.5 MB 95.6 MB 95.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-25664 http://ftp.pdbj.org/pub/emdb/structures/EMD-25664 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-25664 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-25664 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_25664.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_25664.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Local refinement of LRRK2RCKW tetramer bound to 11-pf microtubule with MLi-2 present. Focused on the tetramer only. Sharpened. | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.16 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_25664_msk_1.map emd_25664_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: Non-sharpened map
| ファイル | emd_25664_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Non-sharpened map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map 2
| ファイル | emd_25664_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map 1
| ファイル | emd_25664_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : LRRK2RCKW filament bound to a 11-pf microtubule with MLi-2 present.
| 全体 | 名称: LRRK2RCKW filament bound to a 11-pf microtubule with MLi-2 present. |
|---|---|
| 要素 |
|
-超分子 #1: LRRK2RCKW filament bound to a 11-pf microtubule with MLi-2 present.
| 超分子 | 名称: LRRK2RCKW filament bound to a 11-pf microtubule with MLi-2 present. タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: Mask focused on LRRK2RCKW only. No microtubule present in this map. |
|---|---|
| 分子量 | 理論値: 500 KDa |
-分子 #1: C-terminal of Leucine Rich Repeat Kinase 2
| 分子 | 名称: C-terminal of Leucine Rich Repeat Kinase 2 / タイプ: protein_or_peptide / ID: 1 / 詳細: I2020T mutation Residues 1327-2527 of LRRK2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:   Spodoptera frugiperda (ツマジロクサヨトウ) Spodoptera frugiperda (ツマジロクサヨトウ) |
| 配列 | 文字列: KKAVPYNRMK LMIVGNTGSG KTTLLQQLMK TKKSDLGMQS ATVGIDVKDW PIQIRDKRKR DLVLNVWDF AGREEFYSTH PHFMTQRALY LAVYDLSKGQ AEVDAMKPWL FNIKARASSS P VILVGTHL DVSDEKQRKA CMSKITKELL NKRGFPAIRD YHFVNATEES ...文字列: KKAVPYNRMK LMIVGNTGSG KTTLLQQLMK TKKSDLGMQS ATVGIDVKDW PIQIRDKRKR DLVLNVWDF AGREEFYSTH PHFMTQRALY LAVYDLSKGQ AEVDAMKPWL FNIKARASSS P VILVGTHL DVSDEKQRKA CMSKITKELL NKRGFPAIRD YHFVNATEES DALAKLRKTI IN ESLNFKI RDQLVVGQLI PDCYVELEKI ILSERKNVPI EFPVIDRKRL LQLVRENQLQ LDE NELPHA VHFLNESGVL LHFQDPALQL SDLYFVEPKW LCKIMAQILT VKVEGCPKHP KGII SRRDV EKFLSKKRKF PKNYMSQYFK LLEKFQIALP IGEEYLLVPS SLSDHRPVIE LPHCE NSEI IIRLYEMPYF PMGFWSRLIN RLLEISPYML SGRERALRPN RMYWRQGIYL NWSPEA YCL VGSEVLDNHP ESFLKITVPS CRKGCILLGQ VVDHIDSLME EWFPGLLEID ICGEGET LL KKWALYSFND GEEHQKILLD DLMKKAEEGD LLVNPDQPRL TIPISQIAPD LILADLPR N IMLNNDELEF EQAPEFLLGD GSFGSVYRAA YEGEEVAVKI FNKHTSLRLL RQELVVLCH LHHPSLISLL AAGIRPRMLV MELASKGSLD RLLQQDKASL TRTLQHRIAL HVADGLRYLH SAMIIYRDL KPHNVLLFTL YPNAAIIAKI ADYGTAQYCC RMGIKTSEGT PGFRAPEVAR G NVIYNQQA DVYSFGLLLY DILTTGGRIV EGLKFPNEFD ELEIQGKLPD PVKEYGCAPW PM VEKLIKQ CLKENPQERP TSAQVFDILN SAELVCLTRR ILLPKNVIVE CMVATHHNSR NAS IWLGCG HTDRGQLSFL DLNTEGYTSE EVADSRILCL ALVHLPVEKE SWIVSGTQSG TLLV INTED GKKRHTLEKM TDSVTCLYCN SFSKQSKQKN FLLVGTADGK LAIFEDKTVK LKGAA PLKI LNIGNVSTPL MCLSESTNST ERNVMWGGCG TKIFSFSNDF TIQKLIETRT SQLFSY AAF SDSNIITVVV DTALYIAKQN SPVVEVWDKK TEKLCGLIDC VHFLREVMVK ENKESKH KM SYSGRVKTLC LQKNTALWIG TGGGHILLLD LSTRRLIRVI YNFCNSVRVM MTAQLGSL K NVMLVLGYNR KNTEGTQKQK EIQSCLTVWD INLPHEVQNL EKHIEVRKEL AEKMRRTSV E |
-分子 #2: Tubulin alpha
| 分子 | 名称: Tubulin alpha / タイプ: protein_or_peptide / ID: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Bos taurus (ウシ) Bos taurus (ウシ) |
| 配列 | 文字列: MRECISIHVG QAGVQIGNAC WELYCLEHGI QPDGQMPSDK TIGGGDDSFN TFFSETGAGK HVPRAVFVD LEPTVIDEVR TGTYRQLFHP EQLITGKEDA ANNYARGHYT IGKEIIDLVL D RIRKLADQ CTGLQGFLVF HSFGGGTGSG FTSLLMERLS VDYGKKSKLE ...文字列: MRECISIHVG QAGVQIGNAC WELYCLEHGI QPDGQMPSDK TIGGGDDSFN TFFSETGAGK HVPRAVFVD LEPTVIDEVR TGTYRQLFHP EQLITGKEDA ANNYARGHYT IGKEIIDLVL D RIRKLADQ CTGLQGFLVF HSFGGGTGSG FTSLLMERLS VDYGKKSKLE FSIYPAPQVS TA VVEPYNS ILTTHTTLEH SDCAFMVDNE AIYDICRRNL DIERPTYTNL NRLIGQIVSS ITA SLRFDG ALNVDLTEFQ TNLVPYPRIH FPLATYAPVI SAEKAYHEQL SVAEITNACF EPAN QMVKC DPRHGKYMAC CLLYRGDVVP KDVNAAIATI KTKRTIQFVD WCPTGFKVGI NYQPP TVVP GGDLAKVQRA VCMLSNTTAI AEAWARLDHK FDLMYAKRAF VHWYVGEGME EGEFSE ARE DMAALEKDYE EVGVDSVEGE GEEEGEEY |
-分子 #3: Tubulin beta
| 分子 | 名称: Tubulin beta / タイプ: protein_or_peptide / ID: 3 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Bos taurus (ウシ) Bos taurus (ウシ) |
| 配列 | 文字列: MREIVHIQIG QCGNQIGAKF WEVIGEEHGI DWAGSYCGDS ALQLERISVY YNEAHGKKYV PRAVLVDLE PGTMDSIRSS RVGALFQPDS FVHGNSGAGN NWAKGYYTEG AELVDRVLDA V RTEAEGCD CLQGFQLVHS LGGGTGSGMG TLLLGKIREE YPDRILNSFS ...文字列: MREIVHIQIG QCGNQIGAKF WEVIGEEHGI DWAGSYCGDS ALQLERISVY YNEAHGKKYV PRAVLVDLE PGTMDSIRSS RVGALFQPDS FVHGNSGAGN NWAKGYYTEG AELVDRVLDA V RTEAEGCD CLQGFQLVHS LGGGTGSGMG TLLLGKIREE YPDRILNSFS VMPSPKVSDT VV EPYNAVL ALHQLVLNSD ACFCIDNEAL YDICFRTLRL STPTYGDLNH LVSLTMSGIT TSL RFPGQL NADLRKLAVN MVPFPRLHFF MPGFAPLTAQ GSQQYRALTV AELTQQMFDA RNTM AACDP RRGRYLTVAC IFRGRMSTKE VDEQLLNVQT RNSSCFVEWI PNNVKVAVCD IPPRG LSMA ATFIGNNTAI QELFSRISEH FSAMFKRKAF VHWYTGEGMD INEFTEAESN IQDLVS EYQ QFQDARADVE EEEIGGEAEV EPADKEH |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 構成要素:
詳細: This is the final dilution buffer. The incubation buffer consisted of 1x BRB80, 10% glycerol, 1mM DTT, 1mM GTP, 1mM MgCl2, 10 uM taxol, and 5 uM MLi-2. Sample was diluted 3-fold right before ...詳細: This is the final dilution buffer. The incubation buffer consisted of 1x BRB80, 10% glycerol, 1mM DTT, 1mM GTP, 1mM MgCl2, 10 uM taxol, and 5 uM MLi-2. Sample was diluted 3-fold right before freezing with the final buffer. | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| グリッド | モデル: EMS Lacey Carbon / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: LACEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 45 sec. / 詳細: EMS (LC-300) | ||||||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K | ||||||||||||||||||
| 詳細 | 4.5 uM of LRRK2RCKW was allowed to incubate with 2.25 uM of tubulin dimer, causing both to co-polymerize. 5 uM of MLi-2 was present as well. The sample was diluted 3-fold right before freezing (1.5 uM LRRK2RCKW concentration final). |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TALOS ARCTICA |
|---|---|
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 70.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 1.5 µm / 最小 デフォーカス(公称値): 1.5 µm / 倍率(公称値): 36000 Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 1.5 µm / 最小 デフォーカス(公称値): 1.5 µm / 倍率(公称値): 36000 |
| 試料ステージ | ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 撮影したグリッド数: 2 / 平均露光時間: 10.0 sec. / 平均電子線量: 55.0 e/Å2 / 詳細: 250 ms frames |
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー












 Z
Z Y
Y X
X