+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8c77 | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Human cathepsin L after reaction with the thiocarbazate inhibitor CID 16725315 | ||||||||||||||||||
 要素 要素 | Cathepsin L | ||||||||||||||||||
 キーワード キーワード | HYDROLASE / cystein protease / drug target / lysosome / virus cell entry | ||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報enkephalin processing / cathepsin L / CD4-positive, alpha-beta T cell lineage commitment / macrophage apoptotic process / chromaffin granule / elastin catabolic process / antigen processing and presentation of peptide antigen / RUNX1 regulates transcription of genes involved in differentiation of keratinocytes / endolysosome lumen / cellular response to thyroid hormone stimulus ...enkephalin processing / cathepsin L / CD4-positive, alpha-beta T cell lineage commitment / macrophage apoptotic process / chromaffin granule / elastin catabolic process / antigen processing and presentation of peptide antigen / RUNX1 regulates transcription of genes involved in differentiation of keratinocytes / endolysosome lumen / cellular response to thyroid hormone stimulus / Trafficking and processing of endosomal TLR / zymogen activation / proteoglycan binding / Assembly of collagen fibrils and other multimeric structures / antigen processing and presentation / protein autoprocessing / Collagen degradation / collagen catabolic process / fibronectin binding / serpin family protein binding / collagen binding / Attachment and Entry / Degradation of the extracellular matrix / receptor-mediated endocytosis of virus by host cell / multivesicular body / endocytic vesicle lumen / MHC class II antigen presentation / cysteine-type peptidase activity / lysosomal lumen / proteolysis involved in protein catabolic process / Endosomal/Vacuolar pathway / antigen processing and presentation of exogenous peptide antigen via MHC class II / : / histone binding / adaptive immune response / Attachment and Entry / lysosome / apical plasma membrane / fusion of virus membrane with host plasma membrane / cysteine-type endopeptidase activity / intracellular membrane-bounded organelle / fusion of virus membrane with host endosome membrane / symbiont entry into host cell / Golgi apparatus / proteolysis / extracellular space / extracellular exosome / extracellular region / nucleus / plasma membrane 類似検索 - 分子機能 | ||||||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.7 Å 分子置換 / 解像度: 1.7 Å | ||||||||||||||||||
 データ登録者 データ登録者 | Falke, S. / Lieske, J. / Guenther, S. / Reinke, P.Y.A. / Ewert, W. / Loboda, J. / Karnicar, K. / Usenik, A. / Lindic, N. / Sekirnik, A. ...Falke, S. / Lieske, J. / Guenther, S. / Reinke, P.Y.A. / Ewert, W. / Loboda, J. / Karnicar, K. / Usenik, A. / Lindic, N. / Sekirnik, A. / Chapman, H.N. / Hinrichs, W. / Turk, D. / Meents, A. | ||||||||||||||||||
| 資金援助 |  ドイツ, ドイツ,  スロベニア, 5件 スロベニア, 5件
| ||||||||||||||||||
 引用 引用 |  ジャーナル: J.Med.Chem. / 年: 2024 ジャーナル: J.Med.Chem. / 年: 2024タイトル: Structural Elucidation and Antiviral Activity of Covalent Cathepsin L Inhibitors. 著者: Falke, S. / Lieske, J. / Herrmann, A. / Loboda, J. / Karnicar, K. / Gunther, S. / Reinke, P.Y.A. / Ewert, W. / Usenik, A. / Lindic, N. / Sekirnik, A. / Dretnik, K. / Tsuge, H. / Turk, V. / ...著者: Falke, S. / Lieske, J. / Herrmann, A. / Loboda, J. / Karnicar, K. / Gunther, S. / Reinke, P.Y.A. / Ewert, W. / Usenik, A. / Lindic, N. / Sekirnik, A. / Dretnik, K. / Tsuge, H. / Turk, V. / Chapman, H.N. / Hinrichs, W. / Ebert, G. / Turk, D. / Meents, A. | ||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8c77.cif.gz 8c77.cif.gz | 433.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8c77.ent.gz pdb8c77.ent.gz | 293.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8c77.json.gz 8c77.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8c77_validation.pdf.gz 8c77_validation.pdf.gz | 1.5 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8c77_full_validation.pdf.gz 8c77_full_validation.pdf.gz | 1.5 MB | 表示 | |
| XML形式データ |  8c77_validation.xml.gz 8c77_validation.xml.gz | 40.1 KB | 表示 | |
| CIF形式データ |  8c77_validation.cif.gz 8c77_validation.cif.gz | 56.9 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/c7/8c77 https://data.pdbj.org/pub/pdb/validation_reports/c7/8c77 ftp://data.pdbj.org/pub/pdb/validation_reports/c7/8c77 ftp://data.pdbj.org/pub/pdb/validation_reports/c7/8c77 | HTTPS FTP |
-関連構造データ
| 関連構造データ | 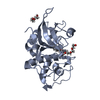 7qkdC  7zs7C  7zvfC  7zxaC  8a4uC  8a4vC  8a4wC  8a4xC  8a5bC  8ahvC  8b4fC  8ofaC  8ozaC  8prxC  8qkbC  7qkcS C: 同じ文献を引用 ( S: 精密化の開始モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||||||
| 2 | 
| ||||||||||||
| 3 | 
| ||||||||||||
| 4 | 
| ||||||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 1種, 4分子 ABCD
| #1: タンパク質 | 分子量: 24161.676 Da / 分子数: 4 / 変異: T110A / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: CTSL, CTSL1 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: CTSL, CTSL1 / 発現宿主:  Komagataella phaffii GS115 (菌類) / 参照: UniProt: P07711 Komagataella phaffii GS115 (菌類) / 参照: UniProt: P07711 |
|---|
-非ポリマー , 8種, 617分子 














| #2: 化合物 | ChemComp-TXH / ~{ #3: 化合物 | ChemComp-EDO / #4: 化合物 | ChemComp-PG4 / #5: 化合物 | ChemComp-DMS / #6: 化合物 | #7: 化合物 | ChemComp-ACT / | #8: 化合物 | ChemComp-PGE / | #9: 水 | ChemComp-HOH / | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|---|
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.14 Å3/Da / 溶媒含有率: 42.45 % |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法, シッティングドロップ法 詳細: Mature cathepsin L at a concentration of 7 mg/ml was equilibrated against 27% w/v PEG 8000, 1 mM TCEP and 0.1 M sodium acetate at pH 4.0. Crystals, which grew at 293 K to final size after ...詳細: Mature cathepsin L at a concentration of 7 mg/ml was equilibrated against 27% w/v PEG 8000, 1 mM TCEP and 0.1 M sodium acetate at pH 4.0. Crystals, which grew at 293 K to final size after approximately 3 days, were transferred to a compound soaking solution containing 22% w/v PEG 8000, 1 mM TCEP and 0.1 M sodium acetate at pH 4.0 as well as 5% v/v DMSO and 10% v/v PEG 400. |
-データ収集
| 回折 | 平均測定温度: 100 K / Serial crystal experiment: N |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  PETRA III, DESY PETRA III, DESY  / ビームライン: P11 / 波長: 1.033 Å / ビームライン: P11 / 波長: 1.033 Å |
| 検出器 | タイプ: DECTRIS EIGER2 X 16M / 検出器: PIXEL / 日付: 2022年10月3日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.033 Å / 相対比: 1 |
| 反射 | 解像度: 1.7→49.57 Å / Num. obs: 81304 / % possible obs: 92.5 % / 冗長度: 10.29 % / Biso Wilson estimate: 19.14 Å2 / CC1/2: 0.995 / Rrim(I) all: 0.4 / Net I/σ(I): 10.32 |
| 反射 シェル | 解像度: 1.7→1.76 Å / Mean I/σ(I) obs: 1.89 / Num. unique obs: 8012 / CC1/2: 0.759 |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 7QKC 解像度: 1.7→49.57 Å / SU ML: 0.1768 / 交差検証法: FREE R-VALUE / σ(F): 1.96 / 位相誤差: 21.2225 立体化学のターゲット値: GeoStd + Monomer Library + CDL v1.2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.11 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 25.39 Å2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.7→49.57 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 手法: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ | Refine-ID: X-RAY DIFFRACTION / Auth seq-ID: 1 - 220
|
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj




















