| 登録情報 | データベース: PDB / ID: 7o86
|
|---|
| タイトル | 1.73A X-ray crystal structure of the conserved C-terminal (CCT) of human SPAK |
|---|
 要素 要素 | STE20/SPS1-related proline-alanine-rich protein kinase |
|---|
 キーワード キーワード | SIGNALING PROTEIN / KINASE / TRANSFERASE / CCT |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
: / : / positive regulation of ion transmembrane transporter activity / negative regulation of pancreatic juice secretion / chemokine (C-X-C motif) ligand 12 signaling pathway / maintenance of lens transparency / negative regulation of potassium ion transmembrane transporter activity / negative regulation of potassium ion transmembrane transport / intracellular chloride ion homeostasis / positive regulation of T cell chemotaxis ...: / : / positive regulation of ion transmembrane transporter activity / negative regulation of pancreatic juice secretion / chemokine (C-X-C motif) ligand 12 signaling pathway / maintenance of lens transparency / negative regulation of potassium ion transmembrane transporter activity / negative regulation of potassium ion transmembrane transport / intracellular chloride ion homeostasis / positive regulation of T cell chemotaxis / renal sodium ion absorption / cellular hypotonic response / macrophage activation / positive regulation of potassium ion transport / cellular response to chemokine / response to aldosterone / cellular hyperosmotic response / positive regulation of p38MAPK cascade / cell volume homeostasis / cellular response to potassium ion / response to dietary excess / peptidyl-threonine phosphorylation / sodium ion transmembrane transport / peptidyl-serine phosphorylation / regulation of blood pressure / kinase activity / protein autophosphorylation / cell body / regulation of inflammatory response / cell cortex / basolateral plasma membrane / protein phosphorylation / non-specific serine/threonine protein kinase / intracellular signal transduction / apical plasma membrane / inflammatory response / protein serine kinase activity / intracellular membrane-bounded organelle / protein serine/threonine kinase activity / protein kinase binding / signal transduction / nucleoplasm / ATP binding / cytoplasm / cytosol類似検索 - 分子機能 Serine/threonine-protein kinase OSR1/WNK, CCT domain / Oxidative-stress-responsive kinase 1 C-terminal domain / : / Protein kinase domain / Serine/Threonine protein kinases, catalytic domain / Protein kinase, ATP binding site / Protein kinases ATP-binding region signature. / Protein kinase domain profile. / Protein kinase domain / Protein kinase-like domain superfamily類似検索 - ドメイン・相同性 STE20/SPS1-related proline-alanine-rich protein kinase類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.73 Å 分子置換 / 解像度: 1.73 Å |
|---|
 データ登録者 データ登録者 | Elvers, K.T. / Bax, B.D. / Lipka-Lloyd, M. / Mehellou, Y. |
|---|
| 資金援助 |  英国, 1件 英国, 1件 | 組織 | 認可番号 | 国 |
|---|
| Medical Research Council (MRC, United Kingdom) | 518455 |  英国 英国 |
|
|---|
 引用 引用 |  ジャーナル: Chembiochem / 年: 2022 ジャーナル: Chembiochem / 年: 2022
タイトル: Structures of the Human SPAK and OSR1 Conserved C-Terminal (CCT) Domains.
著者: Elvers, K.T. / Lipka-Lloyd, M. / Trueman, R.C. / Bax, B.D. / Mehellou, Y. |
|---|
| 履歴 | | 登録 | 2021年4月14日 | 登録サイト: PDBE / 処理サイト: PDBE |
|---|
| 改定 1.0 | 2021年9月22日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2021年11月17日 | Group: Data collection / Database references
カテゴリ: citation / citation_author / pdbx_database_proc
Item: _citation.country / _citation.journal_abbrev ..._citation.country / _citation.journal_abbrev / _citation.journal_id_CSD / _citation.journal_id_ISSN / _citation.pdbx_database_id_DOI / _citation.pdbx_database_id_PubMed / _citation.title / _citation.year |
|---|
| 改定 1.2 | 2022年1月19日 | Group: Data collection / Database references / カテゴリ: citation / citation_author / diffrn_source
Item: _citation.journal_volume / _citation.page_first ..._citation.journal_volume / _citation.page_first / _citation.page_last / _citation.year / _citation_author.identifier_ORCID / _diffrn_source.pdbx_synchrotron_site |
|---|
| 改定 1.3 | 2024年1月31日 | Group: Data collection / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond / pdbx_initial_refinement_model |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.73 Å
分子置換 / 解像度: 1.73 Å  データ登録者
データ登録者 英国, 1件
英国, 1件  引用
引用 ジャーナル: Chembiochem / 年: 2022
ジャーナル: Chembiochem / 年: 2022 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 7o86.cif.gz
7o86.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb7o86.ent.gz
pdb7o86.ent.gz PDB形式
PDB形式 7o86.json.gz
7o86.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 7o86_validation.pdf.gz
7o86_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 7o86_full_validation.pdf.gz
7o86_full_validation.pdf.gz 7o86_validation.xml.gz
7o86_validation.xml.gz 7o86_validation.cif.gz
7o86_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/o8/7o86
https://data.pdbj.org/pub/pdb/validation_reports/o8/7o86 ftp://data.pdbj.org/pub/pdb/validation_reports/o8/7o86
ftp://data.pdbj.org/pub/pdb/validation_reports/o8/7o86 リンク
リンク 集合体
集合体
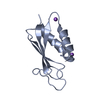

 要素
要素 Homo sapiens (ヒト) / 遺伝子: STK39, SPAK / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: STK39, SPAK / 発現宿主: 
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  Diamond
Diamond  / ビームライン: I03 / 波長: 0.97628 Å
/ ビームライン: I03 / 波長: 0.97628 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj






