+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7nri | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
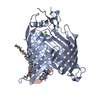
| タイトル | Structure of the darobactin-bound E. coli BAM complex (BamABCDE) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
 要素 要素 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
 キーワード キーワード | MEMBRANE PROTEIN / Beta-Barrel / outer membrane / protein insertion / protein folding / protein maturation / antibiotic / natural product / cyclized peptide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Bam protein complex / Gram-negative-bacterium-type cell outer membrane assembly / protein insertion into membrane / cell outer membrane / protein-macromolecule adaptor activity / cell adhesion / response to antibiotic / cell surface / identical protein binding / membrane 類似検索 - 分子機能 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 生物種 |  synthetic construct (人工物) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.03 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
 データ登録者 データ登録者 | Jakob, R.P. / Kaur, H. / Marzinek, J.K. / Green, R. / Imai, Y. / Bolla, J. / Robinson, C. / Bond, P.J. / Lewis, K. / Maier, T. / Hiller, S. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2021 ジャーナル: Nature / 年: 2021タイトル: The antibiotic darobactin mimics a β-strand to inhibit outer membrane insertase. 著者: Hundeep Kaur / Roman P Jakob / Jan K Marzinek / Robert Green / Yu Imai / Jani Reddy Bolla / Elia Agustoni / Carol V Robinson / Peter J Bond / Kim Lewis / Timm Maier / Sebastian Hiller /     要旨: Antibiotics that target Gram-negative bacteria in new ways are needed to resolve the antimicrobial resistance crisis. Gram-negative bacteria are protected by an additional outer membrane, rendering ...Antibiotics that target Gram-negative bacteria in new ways are needed to resolve the antimicrobial resistance crisis. Gram-negative bacteria are protected by an additional outer membrane, rendering proteins on the cell surface attractive drug targets. The natural compound darobactin targets the bacterial insertase BamA-the central unit of the essential BAM complex, which facilitates the folding and insertion of outer membrane proteins. BamA lacks a typical catalytic centre, and it is not obvious how a small molecule such as darobactin might inhibit its function. Here we resolve the mode of action of darobactin at the atomic level using a combination of cryo-electron microscopy, X-ray crystallography, native mass spectrometry, in vivo experiments and molecular dynamics simulations. Two cyclizations pre-organize the darobactin peptide in a rigid β-strand conformation. This creates a mimic of the recognition signal of native substrates with a superior ability to bind to the lateral gate of BamA. Upon binding, darobactin replaces a lipid molecule from the lateral gate to use the membrane environment as an extended binding pocket. Because the interaction between darobactin and BamA is largely mediated by backbone contacts, it is particularly robust against potential resistance mutations. Our results identify the lateral gate as a functional hotspot in BamA and will allow the rational design of antibiotics that target this bacterial Achilles heel. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7nri.cif.gz 7nri.cif.gz | 495.5 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7nri.ent.gz pdb7nri.ent.gz | 402.5 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7nri.json.gz 7nri.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7nri_validation.pdf.gz 7nri_validation.pdf.gz | 1.5 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7nri_full_validation.pdf.gz 7nri_full_validation.pdf.gz | 1.5 MB | 表示 | |
| XML形式データ |  7nri_validation.xml.gz 7nri_validation.xml.gz | 50.3 KB | 表示 | |
| CIF形式データ |  7nri_validation.cif.gz 7nri_validation.cif.gz | 77 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/nr/7nri https://data.pdbj.org/pub/pdb/validation_reports/nr/7nri ftp://data.pdbj.org/pub/pdb/validation_reports/nr/7nri ftp://data.pdbj.org/pub/pdb/validation_reports/nr/7nri | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-Outer membrane protein assembly factor ... , 5種, 5分子 ABCDE
| #1: タンパク質 | 分子量: 88227.430 Da / 分子数: 1 / 由来タイプ: 組換発現 由来: (組換発現)  株: K12 / 遺伝子: bamA, yaeT, yzzN, yzzY, b0177, JW0172 / プラスミド: pQLink / 発現宿主:  |
|---|---|
| #2: タンパク質 | 分子量: 40924.516 Da / 分子数: 1 / 由来タイプ: 組換発現 由来: (組換発現)  株: K12 / 遺伝子: bamB, yfgL, b2512, JW2496 / プラスミド: pQlink / 発現宿主:  |
| #3: タンパク質 | 分子量: 34401.250 Da / 分子数: 1 / 由来タイプ: 組換発現 由来: (組換発現)  株: K12 / 遺伝子: bamC, dapX, nlpB, b2477, JW2462 / プラスミド: pQlink / 発現宿主:  |
| #4: タンパク質 | 分子量: 25816.818 Da / 分子数: 1 / 由来タイプ: 組換発現 由来: (組換発現)  株: K12 / 遺伝子: bamD, yfiO, b2595, JW2577 / プラスミド: pQLink / 発現宿主:  |
| #5: タンパク質 | 分子量: 11462.772 Da / 分子数: 1 / 由来タイプ: 組換発現 由来: (組換発現)  株: K12 / 遺伝子: bamE, smpA, b2617, JW2598 / プラスミド: pQLink / 発現宿主:  |
-タンパク質・ペプチド , 1種, 1分子 G
| #6: タンパク質・ペプチド | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|---|
| Has protein modification | Y |
| 非ポリマーの詳細 | Original Refinement was done with Darobactin defined as one ligand |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: BamABCDE complex / タイプ: COMPLEX / Entity ID: #2-#5 / 由来: RECOMBINANT | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 実験値: NO | ||||||||||||||||||||
| 由来(天然) | 生物種:  | ||||||||||||||||||||
| 由来(組換発現) | 生物種:  | ||||||||||||||||||||
| 緩衝液 | pH: 8 | ||||||||||||||||||||
| 緩衝液成分 |
| ||||||||||||||||||||
| 試料 | 濃度: 5.5 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | ||||||||||||||||||||
| 試料支持 | グリッドの材料: COPPER / グリッドのサイズ: 200 divisions/in. / グリッドのタイプ: C-flat-1.2/1.3 | ||||||||||||||||||||
| 急速凍結 | 装置: FEI VITROBOT MARK III / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 293 K / 詳細: 4microL of sample applied |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS / 詳細: Manually grid screening, operated by SerialEM |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 165000 X / 最大 デフォーカス(公称値): 1800 nm / 最小 デフォーカス(公称値): 800 nm / Calibrated defocus min: 500 nm / 最大 デフォーカス(補正後): 2200 nm / Cs: 2.7 mm / C2レンズ絞り径: 70 µm / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 平均露光時間: 9 sec. / 電子線照射量: 50 e/Å2 / 検出モード: COUNTING フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 撮影したグリッド数: 1 / 実像数: 5527 |
| 電子光学装置 | エネルギーフィルター名称: GIF Bioquantum / エネルギーフィルタースリット幅: 20 eV |
| 画像スキャン | 動画フレーム数/画像: 45 |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.17.1_3660: / 分類: 精密化 | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||||||||
| CTF補正 | タイプ: NONE | ||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 870023 | ||||||||||||||||||||||||||||||
| 対称性 | 点対称性: C1 (非対称) | ||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.03 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 157474 / クラス平均像の数: 1 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: AB INITIO MODEL / 空間: REAL | ||||||||||||||||||||||||||||||
| 原子モデル構築 | PDB-ID: 5D0O Accession code: 5D0O / Source name: PDB / タイプ: experimental model | ||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj