+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7m65 | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of human islet amyloid polypeptide (hIAPP, or amylin) fibrils seeded by patient extracted fibrils, polymorph 4 | ||||||
 要素 要素 | Islet amyloid polypeptide | ||||||
 キーワード キーワード | PROTEIN FIBRIL / hIAPP / type II diabetes / amyloid | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報amylin receptor 3 signaling pathway / amylin receptor 2 signaling pathway / amylin receptor 1 signaling pathway / amylin receptor signaling pathway / Calcitonin-like ligand receptors / negative regulation of amyloid fibril formation / negative regulation of bone resorption / eating behavior / negative regulation of osteoclast differentiation / Regulation of gene expression in beta cells ...amylin receptor 3 signaling pathway / amylin receptor 2 signaling pathway / amylin receptor 1 signaling pathway / amylin receptor signaling pathway / Calcitonin-like ligand receptors / negative regulation of amyloid fibril formation / negative regulation of bone resorption / eating behavior / negative regulation of osteoclast differentiation / Regulation of gene expression in beta cells / positive regulation of cAMP/PKA signal transduction / bone resorption / negative regulation of protein-containing complex assembly / sensory perception of pain / positive regulation of calcium-mediated signaling / osteoclast differentiation / hormone activity / cell-cell signaling / amyloid-beta binding / G alpha (s) signalling events / positive regulation of MAPK cascade / positive regulation of apoptotic process / Amyloid fiber formation / receptor ligand activity / signaling receptor binding / neuronal cell body / apoptotic process / lipid binding / signal transduction / extracellular space / extracellular region / identical protein binding 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 電子顕微鏡法 / らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 4.1 Å | ||||||
 データ登録者 データ登録者 | Cao, Q. / Boyer, D.R. / Sawaya, M.R. / Eisenberg, D.S. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2021 ジャーナル: Nat Struct Mol Biol / 年: 2021タイトル: Cryo-EM structures of hIAPP fibrils seeded by patient-extracted fibrils reveal new polymorphs and conserved fibril cores. 著者: Qin Cao / David R Boyer / Michael R Sawaya / Romany Abskharon / Lorena Saelices / Binh A Nguyen / Jiahui Lu / Kevin A Murray / Fouad Kandeel / David S Eisenberg /   要旨: Amyloidosis of human islet amyloid polypeptide (hIAPP) is a pathological hallmark of type II diabetes (T2D), an epidemic afflicting nearly 10% of the world's population. To visualize disease-relevant ...Amyloidosis of human islet amyloid polypeptide (hIAPP) is a pathological hallmark of type II diabetes (T2D), an epidemic afflicting nearly 10% of the world's population. To visualize disease-relevant hIAPP fibrils, we extracted amyloid fibrils from islet cells of a T2D donor and amplified their quantity by seeding synthetic hIAPP. Cryo-EM studies revealed four fibril polymorphic atomic structures. Their resemblance to four unseeded hIAPP fibrils varies from nearly identical (TW3) to non-existent (TW2). The diverse repertoire of hIAPP polymorphs appears to arise from three distinct protofilament cores entwined in different combinations. The structural distinctiveness of TW1, TW2 and TW4 suggests they may be faithful replications of the pathogenic seeds. If so, the structures determined here provide the most direct view yet of hIAPP amyloid fibrils formed during T2D. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7m65.cif.gz 7m65.cif.gz | 54 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7m65.ent.gz pdb7m65.ent.gz | 39.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7m65.json.gz 7m65.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7m65_validation.pdf.gz 7m65_validation.pdf.gz | 871.3 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7m65_full_validation.pdf.gz 7m65_full_validation.pdf.gz | 880.5 KB | 表示 | |
| XML形式データ |  7m65_validation.xml.gz 7m65_validation.xml.gz | 18.7 KB | 表示 | |
| CIF形式データ |  7m65_validation.cif.gz 7m65_validation.cif.gz | 27.7 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/m6/7m65 https://data.pdbj.org/pub/pdb/validation_reports/m6/7m65 ftp://data.pdbj.org/pub/pdb/validation_reports/m6/7m65 ftp://data.pdbj.org/pub/pdb/validation_reports/m6/7m65 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  23689MC  7m61C  7m62C  7m64C M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10868 (タイトル: Cryo electron microscopy of hIAPP fibrils seeded by patient-extracted fibrils EMPIAR-10868 (タイトル: Cryo electron microscopy of hIAPP fibrils seeded by patient-extracted fibrilsData size: 9.9 TB Data #1: Unaligned K3 movies of hIAPP fibrils seeded by disease fibrils [micrographs - multiframe]) |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 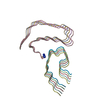
|
|---|---|
| 1 |
|
| 対称性 | らせん対称: (回転対称性: 1 / Dyad axis: no / N subunits divisor: 1 / Num. of operations: 5 / Rise per n subunits: 4.81 Å / Rotation per n subunits: -2.94 °) |
- 要素
要素
| #1: タンパク質・ペプチド | 分子量: 3907.312 Da / 分子数: 10 / 断片: C-terminal amidated peptide (UNP residues 34-70) / 由来タイプ: 合成 / 由来: (合成)  Homo sapiens (ヒト) / 参照: UniProt: P10997 Homo sapiens (ヒト) / 参照: UniProt: P10997Has protein modification | Y | |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: FILAMENT / 3次元再構成法: らせん対称体再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: hIAPP fibril / タイプ: COMPLEX 詳細: Synthetic hIAPP seeded by hIAPP fibrils extracted from a patient with Type II Diabetes Entity ID: all / 由来: NATURAL |
|---|---|
| 分子量 | 単位: KILODALTONS/NANOMETER / 実験値: NO |
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 緩衝液 | pH: 7.4 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 試料支持 | グリッドの材料: COPPER / グリッドのタイプ: Quantifoil R1.2/1.3 |
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 298 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD |
| 撮影 | 電子線照射量: 45 e/Å2 / 検出モード: SUPER-RESOLUTION / フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 3 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||||||
| らせん対称 | 回転角度/サブユニット: -2.94 ° / 軸方向距離/サブユニット: 4.81 Å / らせん対称軸の対称性: C1 | ||||||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 4.1 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 20365 / 対称性のタイプ: HELICAL | ||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | B value: 100 / プロトコル: AB INITIO MODEL / 空間: REAL |
 ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj



