+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7lt3 | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | NHEJ Long-range synaptic complex | |||||||||||||||||||||
 要素 要素 |
| |||||||||||||||||||||
 キーワード キーワード | DNA BINDING PROTEIN/DNA / NHEJ / DNA BINDING PROTEIN / DNA BINDING PROTEIN-DNA complex | |||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報FHA domain binding / positive regulation of chromosome organization / positive regulation of ligase activity / DNA ligase IV complex / positive regulation of platelet formation / DNA ligase activity / Ku70:Ku80 complex / DN2 thymocyte differentiation / DNA ligase (ATP) / negative regulation of t-circle formation ...FHA domain binding / positive regulation of chromosome organization / positive regulation of ligase activity / DNA ligase IV complex / positive regulation of platelet formation / DNA ligase activity / Ku70:Ku80 complex / DN2 thymocyte differentiation / DNA ligase (ATP) / negative regulation of t-circle formation / T cell receptor V(D)J recombination / DNA end binding / pro-B cell differentiation / small-subunit processome assembly / positive regulation of lymphocyte differentiation / DNA ligase (ATP) activity / DNA-dependent protein kinase activity / DNA-dependent protein kinase complex / histone H2AXS139 kinase activity / DNA-dependent protein kinase-DNA ligase 4 complex / immunoglobulin V(D)J recombination / nonhomologous end joining complex / nucleotide-excision repair, DNA gap filling / immature B cell differentiation / single strand break repair / regulation of smooth muscle cell proliferation / cellular response to X-ray / V(D)J recombination / nuclear telomere cap complex / double-strand break repair via alternative nonhomologous end joining / regulation of epithelial cell proliferation / double-strand break repair via classical nonhomologous end joining / isotype switching / Cytosolic sensors of pathogen-associated DNA / protein localization to site of double-strand break / telomere capping / IRF3-mediated induction of type I IFN / regulation of hematopoietic stem cell differentiation / positive regulation of neurogenesis / recombinational repair / regulation of telomere maintenance / protein localization to chromosome, telomeric region / U3 snoRNA binding / DNA biosynthetic process / maturation of 5.8S rRNA / T cell lineage commitment / cellular response to lithium ion / cellular hyperosmotic salinity response / negative regulation of cGAS/STING signaling pathway / positive regulation of double-strand break repair via nonhomologous end joining / response to ionizing radiation / 2-LTR circle formation / B cell lineage commitment / hematopoietic stem cell proliferation / telomeric DNA binding / ligase activity / negative regulation of protein phosphorylation / positive regulation of protein kinase activity / 付加脱離酵素(リアーゼ); 炭素-酸素リアーゼ類; その他の炭素-酸素リアーゼ / site of DNA damage / peptidyl-threonine phosphorylation / T cell differentiation / 5'-deoxyribose-5-phosphate lyase activity / somatic stem cell population maintenance / hematopoietic stem cell differentiation / response to X-ray / chromosome organization / ATP-dependent activity, acting on DNA / ectopic germ cell programmed cell death / somitogenesis / telomere maintenance via telomerase / SUMOylation of DNA damage response and repair proteins / condensed chromosome / DNA polymerase binding / mitotic G1 DNA damage checkpoint signaling / neurogenesis / activation of innate immune response / telomere maintenance / DNA helicase activity / cyclin binding / positive regulation of erythrocyte differentiation / cellular response to leukemia inhibitory factor / positive regulation of translation / B cell differentiation / central nervous system development / stem cell proliferation / response to gamma radiation / cellular response to ionizing radiation / small-subunit processome / Nonhomologous End-Joining (NHEJ) / enzyme activator activity / cellular response to gamma radiation / protein-DNA complex / base-excision repair / regulation of circadian rhythm / brain development / peptidyl-serine phosphorylation / protein destabilization / protein modification process / double-strand break repair via nonhomologous end joining 類似検索 - 分子機能 | |||||||||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.6 Å | |||||||||||||||||||||
 データ登録者 データ登録者 | He, Y. / Chen, S. | |||||||||||||||||||||
| 資金援助 |  米国, 6件 米国, 6件
| |||||||||||||||||||||
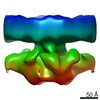
 引用 引用 |  ジャーナル: Nature / 年: 2021 ジャーナル: Nature / 年: 2021タイトル: Structural basis of long-range to short-range synaptic transition in NHEJ. 著者: Siyu Chen / Linda Lee / Tasmin Naila / Susan Fishbain / Annie Wang / Alan E Tomkinson / Susan P Lees-Miller / Yuan He /   要旨: DNA double-strand breaks (DSBs) are a highly cytotoxic form of DNA damage and the incorrect repair of DSBs is linked to carcinogenesis. The conserved error-prone non-homologous end joining (NHEJ) ...DNA double-strand breaks (DSBs) are a highly cytotoxic form of DNA damage and the incorrect repair of DSBs is linked to carcinogenesis. The conserved error-prone non-homologous end joining (NHEJ) pathway has a key role in determining the effects of DSB-inducing agents that are used to treat cancer as well as the generation of the diversity in antibodies and T cell receptors. Here we applied single-particle cryo-electron microscopy to visualize two key DNA-protein complexes that are formed by human NHEJ factors. The Ku70/80 heterodimer (Ku), the catalytic subunit of the DNA-dependent protein kinase (DNA-PKcs), DNA ligase IV (LigIV), XRCC4 and XLF form a long-range synaptic complex, in which the DNA ends are held approximately 115 Å apart. Two DNA end-bound subcomplexes comprising Ku and DNA-PKcs are linked by interactions between the DNA-PKcs subunits and a scaffold comprising LigIV, XRCC4, XLF, XRCC4 and LigIV. The relative orientation of the DNA-PKcs molecules suggests a mechanism for autophosphorylation in trans, which leads to the dissociation of DNA-PKcs and the transition into the short-range synaptic complex. Within this complex, the Ku-bound DNA ends are aligned for processing and ligation by the XLF-anchored scaffold, and a single catalytic domain of LigIV is stably associated with a nick between the two Ku molecules, which suggests that the joining of both strands of a DSB involves both LigIV molecules. | |||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7lt3.cif.gz 7lt3.cif.gz | 2.1 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7lt3.ent.gz pdb7lt3.ent.gz | 1.7 MB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7lt3.json.gz 7lt3.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/lt/7lt3 https://data.pdbj.org/pub/pdb/validation_reports/lt/7lt3 ftp://data.pdbj.org/pub/pdb/validation_reports/lt/7lt3 ftp://data.pdbj.org/pub/pdb/validation_reports/lt/7lt3 | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-X-ray repair cross-complementing protein ... , 2種, 4分子 AJBK
| #1: タンパク質 | 分子量: 69945.039 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: XRCC6, G22P1 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: XRCC6, G22P1 / 発現宿主:  unidentified baculovirus (ウイルス) unidentified baculovirus (ウイルス)参照: UniProt: P12956, 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与, 付加脱離酵素(リアーゼ); 炭素- ...参照: UniProt: P12956, 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与, 付加脱離酵素(リアーゼ); 炭素-酸素リアーゼ類; その他の炭素-酸素リアーゼ #2: タンパク質 | 分子量: 82812.438 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: XRCC5, G22P2 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: XRCC5, G22P2 / 発現宿主:  unidentified baculovirus (ウイルス) unidentified baculovirus (ウイルス)参照: UniProt: P13010, 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 |
|---|
-タンパク質 , 4種, 10分子 CLFGOPHIXY
| #3: タンパク質 | 分子量: 469673.219 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) Homo sapiens (ヒト)参照: UniProt: P78527, non-specific serine/threonine protein kinase #7: タンパク質 | 分子量: 38337.703 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: XRCC4 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: XRCC4 / 発現宿主:  unidentified baculovirus (ウイルス) / 参照: UniProt: Q13426 unidentified baculovirus (ウイルス) / 参照: UniProt: Q13426#8: タンパク質 | 分子量: 33372.234 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: NHEJ1, XLF / 発現宿主: Homo sapiens (ヒト) / 遺伝子: NHEJ1, XLF / 発現宿主:  #9: タンパク質 | 分子量: 104124.953 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: LIG4 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: LIG4 / 発現宿主:  unidentified baculovirus (ウイルス) / 参照: UniProt: P49917, DNA ligase (ATP) unidentified baculovirus (ウイルス) / 参照: UniProt: P49917, DNA ligase (ATP) |
|---|
-DNA鎖 , 2種, 4分子 DMEN
| #5: DNA鎖 | 分子量: 9510.159 Da / 分子数: 2 / 由来タイプ: 合成 / 由来: (合成)  Homo sapiens (ヒト) Homo sapiens (ヒト)#6: DNA鎖 | 分子量: 9236.976 Da / 分子数: 2 / 由来タイプ: 合成 / 由来: (合成)  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
-タンパク質・ペプチド / 非ポリマー , 2種, 4分子 QR

| #10: 化合物 | | #4: タンパク質・ペプチド | 分子量: 1720.111 Da / 分子数: 2 / 由来タイプ: 天然 / 詳細: Maybe a part of PRKDC / 由来: (天然)  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Long-range synaptic Complex of NHEJ / タイプ: COMPLEX / 詳細: DNAPKcs-Ku-XRCC4-LigIV-XLF / Entity ID: #1-#9 / 由来: MULTIPLE SOURCES | |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 1.66 MDa / 実験値: NO | |||||||||||||||||||||||||||||||||||
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||||||||||||||||||||||
| 緩衝液 | pH: 7.9 | |||||||||||||||||||||||||||||||||||
| 緩衝液成分 |
| |||||||||||||||||||||||||||||||||||
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | |||||||||||||||||||||||||||||||||||
| 試料支持 | グリッドの材料: COPPER / グリッドのサイズ: 400 divisions/in. / グリッドのタイプ: Quantifoil R3.5/1 | |||||||||||||||||||||||||||||||||||
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 277 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 顕微鏡 | モデル: JEOL 3200FS |
|---|---|
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: DARK FIELD / 倍率(公称値): 30000 X / 最大 デフォーカス(公称値): 4000 nm / 最小 デフォーカス(公称値): 2000 nm / Cs: 2.7 mm / C2レンズ絞り径: 100 µm |
| 試料ホルダ | 凍結剤: NITROGEN / 試料ホルダーモデル: JEOL |
| 撮影 | 平均露光時間: 0.3 sec. / 電子線照射量: 76.5 e/Å2 / 検出モード: COUNTING フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 撮影したグリッド数: 4 / 実像数: 17114 |
| 画像スキャン | 横: 3710 / 縦: 3838 / 動画フレーム数/画像: 30 / 利用したフレーム数/画像: 1-30 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: NONE | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 1119381 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 点対称性: C2 (2回回転対称) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 4.6 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 329784 / アルゴリズム: FOURIER SPACE / クラス平均像の数: 1 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: FLEXIBLE FIT / 空間: REAL / Target criteria: Correlation coefficient | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 |
|
 ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj





















































