+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7d84 | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | 34-fold symmetry Salmonella S ring formed by full-length FliF | ||||||||||||||||||||||||||||||||||||
 要素 要素 | Flagellar M-ring protein | ||||||||||||||||||||||||||||||||||||
 キーワード キーワード | MEMBRANE PROTEIN / Flagellar motor / Type III protein export system / Transmembrane protein Complex / Torque generation | ||||||||||||||||||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報bacterial-type flagellum basal body, MS ring / cytoskeletal motor activity / bacterial-type flagellum-dependent cell motility / plasma membrane 類似検索 - 分子機能 | ||||||||||||||||||||||||||||||||||||
| 生物種 |  Salmonella enterica serovar Typhimurium (サルモネラ菌) Salmonella enterica serovar Typhimurium (サルモネラ菌) | ||||||||||||||||||||||||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.7 Å | ||||||||||||||||||||||||||||||||||||
 データ登録者 データ登録者 | Kawamoto, A. / Miyata, T. / Makino, F. / Kinoshita, M. / Minamino, T. / Imada, K. / Kato, T. / Namba, K. | ||||||||||||||||||||||||||||||||||||
| 資金援助 |  日本, 11件 日本, 11件
| ||||||||||||||||||||||||||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2021 ジャーナル: Nat Commun / 年: 2021タイトル: Native flagellar MS ring is formed by 34 subunits with 23-fold and 11-fold subsymmetries. 著者: Akihiro Kawamoto / Tomoko Miyata / Fumiaki Makino / Miki Kinoshita / Tohru Minamino / Katsumi Imada / Takayuki Kato / Keiichi Namba /  要旨: The bacterial flagellar MS ring is a transmembrane complex acting as the core of the flagellar motor and template for flagellar assembly. The C ring attached to the MS ring is involved in torque ...The bacterial flagellar MS ring is a transmembrane complex acting as the core of the flagellar motor and template for flagellar assembly. The C ring attached to the MS ring is involved in torque generation and rotation switch, and a large symmetry mismatch between these two rings has been a long puzzle, especially with respect to their role in motor function. Here, using cryoEM structural analysis of the flagellar basal body and the MS ring formed by full-length FliF from Salmonella enterica, we show that the native MS ring is formed by 34 FliF subunits with no symmetry variation. Symmetry analysis of the C ring shows a variation with a peak at 34-fold, suggesting flexibility in C ring assembly. Finally, our data also indicate that FliF subunits assume two different conformations, contributing differentially to the inner and middle parts of the M ring and thus resulting in 23- and 11-fold subsymmetries in the inner and middle M ring, respectively. The internal core of the M ring, formed by 23 subunits, forms a hole of the right size to accommodate the protein export gate. | ||||||||||||||||||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7d84.cif.gz 7d84.cif.gz | 1 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7d84.ent.gz pdb7d84.ent.gz | 812 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7d84.json.gz 7d84.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7d84_validation.pdf.gz 7d84_validation.pdf.gz | 1.3 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7d84_full_validation.pdf.gz 7d84_full_validation.pdf.gz | 1.4 MB | 表示 | |
| XML形式データ |  7d84_validation.xml.gz 7d84_validation.xml.gz | 129.6 KB | 表示 | |
| CIF形式データ |  7d84_validation.cif.gz 7d84_validation.cif.gz | 162.4 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/d8/7d84 https://data.pdbj.org/pub/pdb/validation_reports/d8/7d84 ftp://data.pdbj.org/pub/pdb/validation_reports/d8/7d84 ftp://data.pdbj.org/pub/pdb/validation_reports/d8/7d84 | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 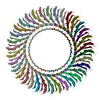
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 61295.645 Da / 分子数: 34 / 由来タイプ: 組換発現 由来: (組換発現)  Salmonella enterica serovar Typhimurium (サルモネラ菌) Salmonella enterica serovar Typhimurium (サルモネラ菌)遺伝子: fliF, fla AII.1, fla BI, STM1969 / 発現宿主:  |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: transmembrane protein complex made of FliF / タイプ: COMPLEX 詳細: the MS ring formed by full-length FliF from Salmonella enterica serovar Typhimurium Entity ID: all / 由来: RECOMBINANT | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 実験値: NO | ||||||||||||||||||||
| 由来(天然) | 生物種:  Salmonella typhimurium (strain LT2 / SGSC1412 / ATCC 700720) (サルモネラ菌) Salmonella typhimurium (strain LT2 / SGSC1412 / ATCC 700720) (サルモネラ菌) | ||||||||||||||||||||
| 由来(組換発現) | 生物種:  | ||||||||||||||||||||
| 緩衝液 | pH: 8 | ||||||||||||||||||||
| 緩衝液成分 |
| ||||||||||||||||||||
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | ||||||||||||||||||||
| 試料支持 | グリッドの材料: COPPER / グリッドのサイズ: 200 divisions/in. / グリッドのタイプ: Quantifoil R1.2/1.3 | ||||||||||||||||||||
| 急速凍結 | 装置: FEI VITROBOT MARK III / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 277 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 75000 X / 最大 デフォーカス(公称値): 3000 nm / 最小 デフォーカス(公称値): 1000 nm / Cs: 2.7 mm / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 電子線照射量: 90 e/Å2 フィルム・検出器のモデル: FEI FALCON II (4k x 4k) 撮影したグリッド数: 1 / 実像数: 1589 |
| 画像スキャン | 横: 4096 / 縦: 4096 / 動画フレーム数/画像: 7 / 利用したフレーム数/画像: 1-6 |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.15.2_3472: / 分類: 精密化 | ||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 339861 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 点対称性: C34 (34回回転対称) | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.7 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 38889 / クラス平均像の数: 1 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: RIGID BODY FIT / 空間: REAL | ||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー

















 PDBj
PDBj
