| 登録情報 | データベース: PDB / ID: 7cy4
|
|---|
| タイトル | Crystal Structure of CMD1 in apo form |
|---|
 要素 要素 | Maltodextrin-binding protein,5-methylcytosine-modifying enzyme 1 |
|---|
 キーワード キーワード | TRANSFERASE / TET / Vitamin C / dioxygenase / 5gmC / DNA modification / 2-oxoglutarate |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
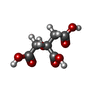
methylcytosine to 5-glyceryl-methylcytosine dioxygenase activity / regulation of photosynthesis / 酸化還元酵素; 電子対供与作用を持つ; 分子酸素を取り込むないしは分子酸素を還元する; その他の電子対酸化酵素 / chromosomal 5-methylcytosine DNA demethylation, oxidation pathway / dioxygenase activity / detection of maltose stimulus / maltose transport complex / carbohydrate transport / carbohydrate transmembrane transporter activity / maltose binding ...methylcytosine to 5-glyceryl-methylcytosine dioxygenase activity / regulation of photosynthesis / 酸化還元酵素; 電子対供与作用を持つ; 分子酸素を取り込むないしは分子酸素を還元する; その他の電子対酸化酵素 / chromosomal 5-methylcytosine DNA demethylation, oxidation pathway / dioxygenase activity / detection of maltose stimulus / maltose transport complex / carbohydrate transport / carbohydrate transmembrane transporter activity / maltose binding / maltose transport / maltodextrin transmembrane transport / ATP-binding cassette (ABC) transporter complex, substrate-binding subunit-containing / ATP-binding cassette (ABC) transporter complex / cell chemotaxis / outer membrane-bounded periplasmic space / periplasmic space / iron ion binding / DNA damage response / nucleus / membrane類似検索 - 分子機能 Maltose/Cyclodextrin ABC transporter, substrate-binding protein / Solute-binding family 1, conserved site / Bacterial extracellular solute-binding proteins, family 1 signature. / Bacterial extracellular solute-binding protein / Bacterial extracellular solute-binding protein類似検索 - ドメイン・相同性 CITRIC ACID / : / Maltodextrin-binding protein / 5-methylcytosine-modifying enzyme 1 / Maltose/maltodextrin-binding periplasmic protein類似検索 - 構成要素 |
|---|
| 生物種 |   Escherichia coli (大腸菌) Escherichia coli (大腸菌)
  Chlamydomonas reinhardtii (クラミドモナス) Chlamydomonas reinhardtii (クラミドモナス) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  単波長異常分散 / 解像度: 2.2 Å 単波長異常分散 / 解像度: 2.2 Å |
|---|
 データ登録者 データ登録者 | Li, W. / Zhang, T. / Sun, M. / Ding, J. |
|---|
| 資金援助 |  中国, 3件 中国, 3件 | 組織 | 認可番号 | 国 |
|---|
| National Natural Science Foundation of China (NSFC) | 31530013 |  中国 中国 | | National Natural Science Foundation of China (NSFC) | 31800622 |  中国 中国 | | Chinese Academy of Sciences | XDB37030305 |  中国 中国 |
|
|---|
 引用 引用 |  ジャーナル: Nat Commun / 年: 2021 ジャーナル: Nat Commun / 年: 2021
タイトル: Molecular mechanism for vitamin C-derived C 5 -glyceryl-methylcytosine DNA modification catalyzed by algal TET homologue CMD1.
著者: Li, W. / Zhang, T. / Sun, M. / Shi, Y. / Zhang, X.J. / Xu, G.L. / Ding, J. |
|---|
| 履歴 | | 登録 | 2020年9月3日 | 登録サイト: PDBJ / 処理サイト: PDBJ |
|---|
| 改定 1.0 | 2020年12月30日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2021年2月10日 | Group: Database references / カテゴリ: citation
Item: _citation.country / _citation.journal_abbrev ..._citation.country / _citation.journal_abbrev / _citation.journal_id_CSD / _citation.journal_id_ISSN / _citation.journal_volume / _citation.pdbx_database_id_DOI / _citation.title / _citation.year |
|---|
| 改定 1.2 | 2021年2月17日 | Group: Database references / カテゴリ: citation / citation_author
Item: _citation.page_first / _citation.page_last ..._citation.page_first / _citation.page_last / _citation.pdbx_database_id_PubMed / _citation.title / _citation_author.name |
|---|
| 改定 1.3 | 2024年3月27日 | Group: Data collection / Database references / カテゴリ: chem_comp_atom / chem_comp_bond / database_2
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報

 X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  単波長異常分散 / 解像度: 2.2 Å
単波長異常分散 / 解像度: 2.2 Å  データ登録者
データ登録者 中国, 3件
中国, 3件  引用
引用 ジャーナル: Nat Commun / 年: 2021
ジャーナル: Nat Commun / 年: 2021 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 7cy4.cif.gz
7cy4.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb7cy4.ent.gz
pdb7cy4.ent.gz PDB形式
PDB形式 7cy4.json.gz
7cy4.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 7cy4_validation.pdf.gz
7cy4_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 7cy4_full_validation.pdf.gz
7cy4_full_validation.pdf.gz 7cy4_validation.xml.gz
7cy4_validation.xml.gz 7cy4_validation.cif.gz
7cy4_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/cy/7cy4
https://data.pdbj.org/pub/pdb/validation_reports/cy/7cy4 ftp://data.pdbj.org/pub/pdb/validation_reports/cy/7cy4
ftp://data.pdbj.org/pub/pdb/validation_reports/cy/7cy4 リンク
リンク 集合体
集合体
 要素
要素


 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  SSRF
SSRF  / ビームライン: BL19U1 / 波長: 0.9785 Å
/ ビームライン: BL19U1 / 波長: 0.9785 Å 解析
解析 単波長異常分散 / 解像度: 2.2→47.77 Å / Cor.coef. Fo:Fc: 0.958 / Cor.coef. Fo:Fc free: 0.939 / SU B: 16.282 / SU ML: 0.169 / 交差検証法: THROUGHOUT / σ(F): 0 / ESU R Free: 0.206 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: U VALUES : WITH TLS ADDED
単波長異常分散 / 解像度: 2.2→47.77 Å / Cor.coef. Fo:Fc: 0.958 / Cor.coef. Fo:Fc free: 0.939 / SU B: 16.282 / SU ML: 0.169 / 交差検証法: THROUGHOUT / σ(F): 0 / ESU R Free: 0.206 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: U VALUES : WITH TLS ADDED ムービー
ムービー コントローラー
コントローラー

















 PDBj
PDBj