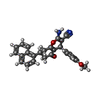
登録情報 データベース : PDB / ID : 7awqタイトル Structure of the thermostabilized EAAT1 cryst-E386Q mutant in complex with L-ASP, sodium ions and the allosteric inhibitor UCPH101 Excitatory amino acid transporter 1,Neutral amino acid transporter B(0),Excitatory amino acid transporter 1 キーワード / / / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / / / 解像度 : 3.65 Å データ登録者 Canul-Tec, J.C. / Legrand, P. / Reyes, N. 資金援助 組織 認可番号 国 European Research Council (ERC) 309657
ジャーナル : EMBO J / 年 : 2022タイトル : The ion-coupling mechanism of human excitatory amino acid transporters.著者 : Juan C Canul-Tec / Anand Kumar / Jonathan Dhenin / Reda Assal / Pierre Legrand / Martial Rey / Julia Chamot-Rooke / Nicolas Reyes / 要旨 : Excitatory amino acid transporters (EAATs) maintain glutamate gradients in the brain essential for neurotransmission and to prevent neuronal death. They use ionic gradients as energy source and co- ... Excitatory amino acid transporters (EAATs) maintain glutamate gradients in the brain essential for neurotransmission and to prevent neuronal death. They use ionic gradients as energy source and co-transport transmitter into the cytoplasm with Na and H , while counter-transporting K to re-initiate the transport cycle. However, the molecular mechanisms underlying ion-coupled transport remain incompletely understood. Here, we present 3D X-ray crystallographic and cryo-EM structures, as well as thermodynamic analysis of human EAAT1 in different ion bound conformations, including elusive counter-transport ion bound states. Binding energies of Na and H , and unexpectedly Ca , are coupled to neurotransmitter binding. Ca competes for a conserved Na site, suggesting a regulatory role for Ca in glutamate transport at the synapse, while H binds to a conserved glutamate residue stabilizing substrate occlusion. The counter-transported ion binding site overlaps with that of glutamate, revealing the K -based mechanism to exclude the transmitter during the transport cycle and to prevent its neurotoxic release on the extracellular side. 履歴 登録 2020年11月8日 登録サイト / 処理サイト 改定 1.0 2021年10月13日 Provider / タイプ 改定 1.1 2021年12月1日 Group / カテゴリ / citation_authorItem _citation.country / _citation.journal_abbrev ... _citation.country / _citation.journal_abbrev / _citation.journal_id_ASTM / _citation.journal_id_CSD / _citation.journal_id_ISSN / _citation.page_first / _citation.page_last / _citation.pdbx_database_id_DOI / _citation.pdbx_database_id_PubMed / _citation.title / _citation.year 改定 1.2 2022年1月12日 Group / カテゴリ / citation_authorItem _citation.journal_volume / _citation.page_first ... _citation.journal_volume / _citation.page_first / _citation.page_last / _citation.year / _citation_author.identifier_ORCID 改定 1.3 2022年1月19日 Group / カテゴリ / citation_authorItem / _citation.page_last / _citation_author.identifier_ORCID改定 1.4 2024年1月31日 Group / Refinement descriptionカテゴリ / chem_comp_bond / pdbx_initial_refinement_model
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 3.65 Å
分子置換 / 解像度: 3.65 Å  データ登録者
データ登録者 フランス, 1件
フランス, 1件  引用
引用 ジャーナル: EMBO J / 年: 2022
ジャーナル: EMBO J / 年: 2022
 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 7awq.cif.gz
7awq.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb7awq.ent.gz
pdb7awq.ent.gz PDB形式
PDB形式 7awq.json.gz
7awq.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 7awq_validation.pdf.gz
7awq_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 7awq_full_validation.pdf.gz
7awq_full_validation.pdf.gz 7awq_validation.xml.gz
7awq_validation.xml.gz 7awq_validation.cif.gz
7awq_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/aw/7awq
https://data.pdbj.org/pub/pdb/validation_reports/aw/7awq ftp://data.pdbj.org/pub/pdb/validation_reports/aw/7awq
ftp://data.pdbj.org/pub/pdb/validation_reports/aw/7awq リンク
リンク 集合体
集合体

 要素
要素 Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト) / 組織 (発現宿主): embrionic kidney / 参照: UniProt: P43003, UniProt: Q15758
Homo sapiens (ヒト) / 組織 (発現宿主): embrionic kidney / 参照: UniProt: P43003, UniProt: Q15758 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  ESRF
ESRF  / ビームライン: ID29 / 波長: 0.9793 Å
/ ビームライン: ID29 / 波長: 0.9793 Å 分子置換
分子置換 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー


















 PDBj
PDBj