+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6wau | ||||||
|---|---|---|---|---|---|---|---|
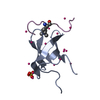
| タイトル | Complex structure of PHF19 | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | GENE REGULATION / PHF19 / Tudor / histone variant / complex / Structural Genomics / Structural Genomics Consortium / SGC | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報histone H3K36me3 reader activity / spermatogonial cell division / DNA replication-dependent chromatin assembly / ESC/E(Z) complex / histone H3K4me3 reader activity / stem cell population maintenance / negative regulation of gene expression, epigenetic / : / regulation of cell differentiation / heterochromatin ...histone H3K36me3 reader activity / spermatogonial cell division / DNA replication-dependent chromatin assembly / ESC/E(Z) complex / histone H3K4me3 reader activity / stem cell population maintenance / negative regulation of gene expression, epigenetic / : / regulation of cell differentiation / heterochromatin / Packaging Of Telomere Ends / Recognition and association of DNA glycosylase with site containing an affected purine / Cleavage of the damaged purine / Recognition and association of DNA glycosylase with site containing an affected pyrimidine / Cleavage of the damaged pyrimidine / Inhibition of DNA recombination at telomere / Meiotic synapsis / Condensation of Prophase Chromosomes / condensed nuclear chromosome / PRC2 methylates histones and DNA / stem cell differentiation / Nonhomologous End-Joining (NHEJ) / Formation of the beta-catenin:TCF transactivating complex / G2/M DNA damage checkpoint / DNA Damage/Telomere Stress Induced Senescence / Meiotic recombination / structural constituent of chromatin / Recruitment and ATM-mediated phosphorylation of repair and signaling proteins at DNA double strand breaks / nucleosome / nucleosome assembly / Processing of DNA double-strand break ends / chromatin organization / chromosome, telomeric region / protein heterodimerization activity / chromatin binding / negative regulation of transcription by RNA polymerase II / DNA binding / extracellular exosome / zinc ion binding / nucleoplasm / nucleus 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.75 Å 分子置換 / 解像度: 1.75 Å | ||||||
 データ登録者 データ登録者 | Dong, C. / Bountra, C. / Edwards, A.M. / Arrowsmith, C.H. / Min, J.R. / Structural Genomics Consortium (SGC) | ||||||
 引用 引用 |  ジャーナル: Elife / 年: 2020 ジャーナル: Elife / 年: 2020タイトル: Structural basis for histone variant H3tK27me3 recognition by PHF1 and PHF19. 著者: Dong, C. / Nakagawa, R. / Oyama, K. / Yamamoto, Y. / Zhang, W. / Dong, A. / Li, Y. / Yoshimura, Y. / Kamiya, H. / Nakayama, J.I. / Ueda, J. / Min, J. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6wau.cif.gz 6wau.cif.gz | 92.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6wau.ent.gz pdb6wau.ent.gz | 67.9 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6wau.json.gz 6wau.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  6wau_validation.pdf.gz 6wau_validation.pdf.gz | 501.3 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  6wau_full_validation.pdf.gz 6wau_full_validation.pdf.gz | 504.3 KB | 表示 | |
| XML形式データ |  6wau_validation.xml.gz 6wau_validation.xml.gz | 15.4 KB | 表示 | |
| CIF形式データ |  6wau_validation.cif.gz 6wau_validation.cif.gz | 22.1 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/wa/6wau https://data.pdbj.org/pub/pdb/validation_reports/wa/6wau ftp://data.pdbj.org/pub/pdb/validation_reports/wa/6wau ftp://data.pdbj.org/pub/pdb/validation_reports/wa/6wau | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 3 | 
| ||||||||
| 4 | 
| ||||||||
| 5 | 
| ||||||||
| 6 | 
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 6907.817 Da / 分子数: 6 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: PHF19, PCL3 / プラスミド: pET28-MHL / 発現宿主: Homo sapiens (ヒト) / 遺伝子: PHF19, PCL3 / プラスミド: pET28-MHL / 発現宿主:  #2: タンパク質・ペプチド | 分子量: 1245.491 Da / 分子数: 6 / 由来タイプ: 合成 / 由来: (合成)  Homo sapiens (ヒト) / 参照: UniProt: Q16695 Homo sapiens (ヒト) / 参照: UniProt: Q16695#3: 化合物 | ChemComp-UNX / #4: 水 | ChemComp-HOH / | 研究の焦点であるリガンドがあるか | Y | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.52 Å3/Da / 溶媒含有率: 51.25 % / Mosaicity: 0.16 ° |
|---|---|
| 結晶化 | 温度: 277 K / 手法: 蒸気拡散法, シッティングドロップ法 / pH: 7 詳細: 2.3M ammonium phosphate dibasic and 0.1M Tris pH 8.5 |
-データ収集
| 回折 | 平均測定温度: 100 K / Serial crystal experiment: N | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  CLSI CLSI  / ビームライン: 08B1-1 / 波長: 0.97951 Å / ビームライン: 08B1-1 / 波長: 0.97951 Å | ||||||||||||||||||||||||||||||
| 検出器 | タイプ: RAYONIX MX300HE / 検出器: CCD / 日付: 2016年5月12日 | ||||||||||||||||||||||||||||||
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | ||||||||||||||||||||||||||||||
| 放射波長 | 波長: 0.97951 Å / 相対比: 1 | ||||||||||||||||||||||||||||||
| Reflection twin |
| ||||||||||||||||||||||||||||||
| 反射 | 解像度: 1.71→55.74 Å / Num. obs: 51838 / % possible obs: 99.4 % / 冗長度: 5.4 % / CC1/2: 1 / Rmerge(I) obs: 0.048 / Rpim(I) all: 0.023 / Rrim(I) all: 0.054 / Net I/σ(I): 21.6 / Num. measured all: 279619 | ||||||||||||||||||||||||||||||
| 反射 シェル | Diffraction-ID: 1
|
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 4HCZ 解像度: 1.75→48.271 Å / Cor.coef. Fo:Fc: 0.954 / Cor.coef. Fo:Fc free: 0.944 / SU B: 1.728 / SU ML: 0.06 / 交差検証法: FREE R-VALUE / ESU R: 0.024 / ESU R Free: 0.024 / 詳細: Hydrogens have been added in their riding positions
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.2 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 26.856 Å2
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.75→48.271 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | Refine-ID: X-RAY DIFFRACTION / Total num. of bins used: 20
|
 ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj







