| 登録情報 | データベース: PDB / ID: 6ems
|
|---|
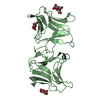
| タイトル | Crystal Structure of dual specific Trm10 construct from Thermococcus kodakaraensis. |
|---|
 要素 要素 | tRNA (guanine(9)-/adenine(9)-N1)-methyltransferase |
|---|
 キーワード キーワード | RNA BINDING PROTEIN / Trm10 / Dual specificity enzymes / SPOUT / MTases |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
tRNA (adenine9-N1)-methyltransferase / tRNA (adenine(9)-N1)-methyltransferase activity / tRNA (guanine9-N1)-methyltransferase / tRNA (guanosine(9)-N1)-methyltransferase activity / tRNA methylation / tRNA processing / cytoplasm類似検索 - 分子機能 : / tRNA methyltransferase, archaea / tRNA methyltransferase TRM10-type domain / tRNA methyltransferase TRM10-type domain superfamily / SAM-dependent methyltransferase TRM10-type domain profile.類似検索 - ドメイン・相同性 tRNA (guanine(9)-/adenine(9)-N1)-methyltransferase類似検索 - 構成要素 |
|---|
| 生物種 |   Thermococcus kodakarensis (古細菌) Thermococcus kodakarensis (古細菌) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.996 Å 分子置換 / 解像度: 1.996 Å |
|---|
 データ登録者 データ登録者 | Singh, R.K. / Versees, W. |
|---|
| 資金援助 |  ベルギー, 1件 ベルギー, 1件 | 組織 | 認可番号 | 国 |
|---|
| Fonds voor Wetenschappelijk Onderzoek (FWO) | |  ベルギー ベルギー |
|
|---|
 引用 引用 |  ジャーナル: RNA / 年: 2018 ジャーナル: RNA / 年: 2018
タイトル: Structural and biochemical analysis of the dual-specificity Trm10 enzyme fromThermococcus kodakaraensisprompts reconsideration of its catalytic mechanism.
著者: Singh, R.K. / Feller, A. / Roovers, M. / Van Elder, D. / Wauters, L. / Droogmans, L. / Versees, W. |
|---|
| 履歴 | | 登録 | 2017年10月3日 | 登録サイト: PDBE / 処理サイト: PDBE |
|---|
| 改定 1.0 | 2018年6月13日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2018年7月25日 | Group: Data collection / Database references / カテゴリ: citation
Item: _citation.journal_volume / _citation.page_first / _citation.page_last |
|---|
| 改定 1.2 | 2024年1月17日 | Group: Data collection / Database references / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model / refine_hist
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _refine_hist.d_res_high / _refine_hist.d_res_low |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 Thermococcus kodakarensis (古細菌)
Thermococcus kodakarensis (古細菌) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 1.996 Å
分子置換 / 解像度: 1.996 Å  データ登録者
データ登録者 ベルギー, 1件
ベルギー, 1件  引用
引用 ジャーナル: RNA / 年: 2018
ジャーナル: RNA / 年: 2018 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6ems.cif.gz
6ems.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6ems.ent.gz
pdb6ems.ent.gz PDB形式
PDB形式 6ems.json.gz
6ems.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 6ems_validation.pdf.gz
6ems_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 6ems_full_validation.pdf.gz
6ems_full_validation.pdf.gz 6ems_validation.xml.gz
6ems_validation.xml.gz 6ems_validation.cif.gz
6ems_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/em/6ems
https://data.pdbj.org/pub/pdb/validation_reports/em/6ems ftp://data.pdbj.org/pub/pdb/validation_reports/em/6ems
ftp://data.pdbj.org/pub/pdb/validation_reports/em/6ems リンク
リンク 集合体
集合体
 要素
要素
 Thermococcus kodakarensis (strain ATCC BAA-918 / JCM 12380 / KOD1) (古細菌)
Thermococcus kodakarensis (strain ATCC BAA-918 / JCM 12380 / KOD1) (古細菌)
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  SOLEIL
SOLEIL  / ビームライン: PROXIMA 2 / 波長: 0.9801 Å
/ ビームライン: PROXIMA 2 / 波長: 0.9801 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー
















 PDBj
PDBj
