[English] 日本語
 Yorodumi
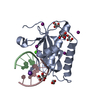
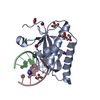
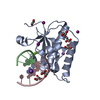
Yorodumi- PDB-6dpn: Crystal Structure of Bacillus Halodurans Ribonuclease H1 E188A in... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 6dpn | ||||||
|---|---|---|---|---|---|---|---|
| Title | Crystal Structure of Bacillus Halodurans Ribonuclease H1 E188A in Complex with an RNA/DNA Hybrid: Reaction in 2 mM Mg2+ and 200 mM K+ for 200 s at 21 C | ||||||
 Components Components |
| ||||||
 Keywords Keywords | HYDROLASE/RNA/DNA / protein-RNA-DNA complex / double helix / RNA hydrolysis / in crystallo catalysis / metal dependent catalysis / monovalent cations / divalent cations / HYDROLASE-RNA-DNA complex | ||||||
| Function / homology |  Function and homology information Function and homology informationDNA replication, removal of RNA primer / ribonuclease H / RNA-DNA hybrid ribonuclease activity / nucleic acid binding / metal ion binding / cytoplasm Similarity search - Function | ||||||
| Biological species |  Bacillus halodurans (bacteria) Bacillus halodurans (bacteria)synthetic construct (others) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 1.493 Å MOLECULAR REPLACEMENT / Resolution: 1.493 Å | ||||||
 Authors Authors | Samara, N.L. / Yang, W. | ||||||
 Citation Citation |  Journal: Nat. Struct. Mol. Biol. / Year: 2018 Journal: Nat. Struct. Mol. Biol. / Year: 2018Title: Cation trafficking propels RNA hydrolysis. Authors: Samara, N.L. / Yang, W. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  6dpn.cif.gz 6dpn.cif.gz | 118.5 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb6dpn.ent.gz pdb6dpn.ent.gz | 86.6 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  6dpn.json.gz 6dpn.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/dp/6dpn https://data.pdbj.org/pub/pdb/validation_reports/dp/6dpn ftp://data.pdbj.org/pub/pdb/validation_reports/dp/6dpn ftp://data.pdbj.org/pub/pdb/validation_reports/dp/6dpn | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  6dmnC  6dmvC  6do8C  6do9C  6doaC  6dobC  6docC  6dodC  6doeC  6dofC  6dogC  6dohC  6doiC  6dojC  6dokC  6dolC  6domC  6donC  6dooC  6dopC  6doqC  6dorC  6dosC  6dotC  6douC  6dovC  6dowC  6doxC  6doyC  6dozC  6dp0C  6dp1C  6dp2C  6dp3C  6dp4C  6dp5C  6dp6C  6dp7C  6dp8C  6dp9C  6dpaC  6dpbC  6dpcC  6dpdC  6dpeC  6dpfC  6dpgC  6dphC  6dpiC  6dpjC  6dpkC  6dplC  6dpmC  6dpoC  6dppC  1zblS S: Starting model for refinement C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
|
- Components
Components
-RNA chain , 2 types, 2 molecules Bb
| #2: RNA chain | Mass: 1224.802 Da / Num. of mol.: 1 / Source method: obtained synthetically / Source: (synth.) synthetic construct (others) |
|---|---|
| #3: RNA chain | Mass: 605.430 Da / Num. of mol.: 1 / Source method: obtained synthetically / Source: (synth.) synthetic construct (others) |
-Protein / DNA chain , 2 types, 2 molecules AC
| #1: Protein | Mass: 16272.427 Da / Num. of mol.: 1 / Fragment: Catalytic Domain / Mutation: E188A Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Bacillus halodurans (bacteria) / Gene: rnhA, BH0863 / Plasmid: pET15b / Production host: Bacillus halodurans (bacteria) / Gene: rnhA, BH0863 / Plasmid: pET15b / Production host:  |
|---|---|
| #4: DNA chain | Mass: 1824.228 Da / Num. of mol.: 1 / Source method: obtained synthetically / Source: (synth.) synthetic construct (others) |
-Non-polymers , 6 types, 200 molecules 










| #5: Chemical | | #6: Chemical | #7: Chemical | ChemComp-IOD / #8: Chemical | ChemComp-GOL / #9: Chemical | #10: Water | ChemComp-HOH / | |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.45 Å3/Da / Density % sol: 49.84 % / Mosaicity: 0 ° |
|---|---|
| Crystal grow | Temperature: 294 K / Method: vapor diffusion, hanging drop Details: 14% PEG3350, 20% glycerol, 200 mM KI, and 25 mM CaCl2 |
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  APS APS  / Beamline: 22-BM / Wavelength: 1 Å / Beamline: 22-BM / Wavelength: 1 Å |
| Detector | Type: MARMOSAIC 225 mm CCD / Detector: CCD / Date: Mar 14, 2015 |
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 1 Å / Relative weight: 1 |
| Reflection | Resolution: 1.49→19.89 Å / Num. obs: 29802 / % possible obs: 97.7 % / Redundancy: 1 % / Net I/σ(I): 6.6 |
| Reflection shell | Resolution: 1.49→1.52 Å / Redundancy: 1 % / % possible all: 75.4 |
- Processing
Processing
| Software |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: PDBID 1ZBL Resolution: 1.493→19.893 Å / SU ML: 0.17 / Cross valid method: THROUGHOUT / σ(F): 1.35 / Phase error: 20.04 / Stereochemistry target values: ML
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Shrinkage radii: 0.9 Å / VDW probe radii: 1.11 Å / Solvent model: FLAT BULK SOLVENT MODEL | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 1.493→19.893 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller













 PDBj
PDBj




