[English] 日本語
 Yorodumi
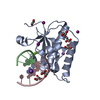
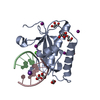
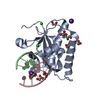
Yorodumi- PDB-6dp9: Crystal Structure of Bacillus Halodurans Ribonuclease H1 in Compl... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 6dp9 | ||||||
|---|---|---|---|---|---|---|---|
| Title | Crystal Structure of Bacillus Halodurans Ribonuclease H1 in Complex with an RNA/DNA Hybrid: Reaction in 2 mM Mn2+ and 200 mM K+ for 40 s at 21 C | ||||||
 Components Components |
| ||||||
 Keywords Keywords | HYDROLASE/DNA/RNA / protein-RNA-DNA complex / double helix / RNA hydrolysis / in crystallo catalysis / metal dependent catalysis / monovalent cations / divalent cations / HYDROLASE-DNA-RNA complex | ||||||
| Function / homology |  Function and homology information Function and homology informationDNA replication, removal of RNA primer / ribonuclease H / RNA-DNA hybrid ribonuclease activity / nucleic acid binding / metal ion binding / cytoplasm Similarity search - Function | ||||||
| Biological species |  Bacillus halodurans (bacteria) Bacillus halodurans (bacteria)synthetic (others) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 1.4 Å MOLECULAR REPLACEMENT / Resolution: 1.4 Å | ||||||
 Authors Authors | Samara, N.L. / Yang, W. | ||||||
 Citation Citation |  Journal: Nat. Struct. Mol. Biol. / Year: 2018 Journal: Nat. Struct. Mol. Biol. / Year: 2018Title: Cation trafficking propels RNA hydrolysis. Authors: Samara, N.L. / Yang, W. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  6dp9.cif.gz 6dp9.cif.gz | 123.6 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb6dp9.ent.gz pdb6dp9.ent.gz | 90.6 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  6dp9.json.gz 6dp9.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/dp/6dp9 https://data.pdbj.org/pub/pdb/validation_reports/dp/6dp9 ftp://data.pdbj.org/pub/pdb/validation_reports/dp/6dp9 ftp://data.pdbj.org/pub/pdb/validation_reports/dp/6dp9 | HTTPS FTP |
|---|
-Group deposition
| ID | G_1001001 (54 entries) |
|---|---|
| Title | Cleavage of RNA by B. Halodurans Ribonuclease H1 |
| Type | undefined |
| Description | The structures represent different time points in the divalent and monovalent metal-dependent hydrolysis reaction of RNA by Ribonuclease H1, which is bound to an RNA/DNA hybrid in the crystal. |
-Related structure data
| Related structure data |  1zblS S: Starting model for refinement |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 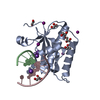
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
|
- Components
Components
-RNA chain , 2 types, 2 molecules Bb
| #2: RNA chain | Mass: 1224.802 Da / Num. of mol.: 1 / Source method: obtained synthetically / Source: (synth.) synthetic (others) |
|---|---|
| #3: RNA chain | Mass: 605.430 Da / Num. of mol.: 1 / Source method: obtained synthetically / Source: (synth.) synthetic (others) |
-Protein / DNA chain , 2 types, 2 molecules AC
| #1: Protein | Mass: 15716.729 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Bacillus halodurans (strain ATCC BAA-125 / DSM 18197 / FERM 7344 / JCM 9153 / C-125) (bacteria) Bacillus halodurans (strain ATCC BAA-125 / DSM 18197 / FERM 7344 / JCM 9153 / C-125) (bacteria)Strain: ATCC BAA-125 / DSM 18197 / FERM 7344 / JCM 9153 / C-125 Gene: rnhA, BH0863 / Plasmid: pET15b / Production host:  |
|---|---|
| #4: DNA chain | Mass: 1824.228 Da / Num. of mol.: 1 / Source method: obtained synthetically / Source: (synth.) synthetic (others) |
-Non-polymers , 6 types, 196 molecules 










| #5: Chemical | | #6: Chemical | #7: Chemical | ChemComp-IOD / #8: Chemical | ChemComp-GOL / #9: Chemical | #10: Water | ChemComp-HOH / | |
|---|
-Details
| Compound details | Note that chain B was split into 2 chains (B and b) at the position 4-5, and the LINK record was ...Note that chain B was split into 2 chains (B and b) at the position 4-5, and the LINK record was introduced to link these two chains. This was done to accommodate the cases observed in the related entries, where the cleavage does occur |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.46 Å3/Da / Density % sol: 49.96 % / Mosaicity: 0 ° |
|---|---|
| Crystal grow | Temperature: 294 K / Method: vapor diffusion, hanging drop Details: 14% PEG3350, 20% glycerol, 200 mM KI, and 25 mM CaCl2 |
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  APS APS  / Beamline: 22-BM / Wavelength: 1 Å / Beamline: 22-BM / Wavelength: 1 Å |
| Detector | Type: MARMOSAIC 225 mm CCD / Detector: CCD / Date: Dec 12, 2016 |
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 1 Å / Relative weight: 1 |
| Reflection | Resolution: 1.4→19.77 Å / Num. obs: 33786 / % possible obs: 91.5 % / Redundancy: 1 % / Biso Wilson estimate: 19.03 Å2 / Net I/σ(I): 8.6 / Num. measured all: 33786 |
| Reflection shell | Resolution: 1.4→1.42 Å / Redundancy: 1 % / Num. unique obs: 1478 / % possible all: 82.9 |
- Processing
Processing
| Software |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: 1ZBL Resolution: 1.4→19.767 Å / SU ML: 0.18 / Cross valid method: THROUGHOUT / σ(F): 1.36 / Phase error: 22.13 Details: Structures refined in Phenix and nucleic acid and protein residues built in Coot
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Shrinkage radii: 0.9 Å / VDW probe radii: 1.11 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso max: 85.36 Å2 / Biso mean: 30.3883 Å2 / Biso min: 12.98 Å2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: final / Resolution: 1.4→19.767 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Refine-ID: X-RAY DIFFRACTION / Rfactor Rfree error: 0 / Total num. of bins used: 12
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller


























 PDBj
PDBj




