| 登録情報 | データベース: PDB / ID: 5z0b
|
|---|
| タイトル | Crystal structure of plasma-derived human serum albumin |
|---|
 要素 要素 | Serum albumin |
|---|
 キーワード キーワード | TRANSPORT PROTEIN / Human serum albumin |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
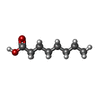
Ciprofloxacin ADME / exogenous protein binding / cellular response to calcium ion starvation / enterobactin binding / Heme biosynthesis / HDL remodeling / negative regulation of mitochondrial depolarization / Heme degradation / Prednisone ADME / Aspirin ADME ...Ciprofloxacin ADME / exogenous protein binding / cellular response to calcium ion starvation / enterobactin binding / Heme biosynthesis / HDL remodeling / negative regulation of mitochondrial depolarization / Heme degradation / Prednisone ADME / Aspirin ADME / antioxidant activity / toxic substance binding / Scavenging of heme from plasma / Recycling of bile acids and salts / platelet alpha granule lumen / fatty acid binding / cellular response to starvation / Post-translational protein phosphorylation / Cytoprotection by HMOX1 / Regulation of Insulin-like Growth Factor (IGF) transport and uptake by Insulin-like Growth Factor Binding Proteins (IGFBPs) / pyridoxal phosphate binding / Platelet degranulation / protein-folding chaperone binding / blood microparticle / endoplasmic reticulum lumen / copper ion binding / endoplasmic reticulum / Golgi apparatus / protein-containing complex / extracellular space / DNA binding / extracellular exosome / extracellular region / identical protein binding / nucleus / cytoplasm類似検索 - 分子機能 Serum Albumin; Chain A, Domain 1 - #10 / Serum albumin/Alpha-fetoprotein/Afamin / ALB/AFP/VDB / Serum albumin, N-terminal / Serum albumin, conserved site / Serum albumin-like / Serum albumin family / Albumin domain signature. / Albumin domain profile. / serum albumin ...Serum Albumin; Chain A, Domain 1 - #10 / Serum albumin/Alpha-fetoprotein/Afamin / ALB/AFP/VDB / Serum albumin, N-terminal / Serum albumin, conserved site / Serum albumin-like / Serum albumin family / Albumin domain signature. / Albumin domain profile. / serum albumin / Serum Albumin; Chain A, Domain 1 / Orthogonal Bundle / Mainly Alpha類似検索 - ドメイン・相同性 LINOLEIC ACID / OCTANOIC ACID (CAPRYLIC ACID) / DI(HYDROXYETHYL)ETHER / TRIETHYLENE GLYCOL / PALMITIC ACID / TRYPTOPHAN / Albumin類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.17 Å 分子置換 / 解像度: 2.17 Å |
|---|
 データ登録者 データ登録者 | Park, J. / Kim, M.-S. / Shin, D.H. |
|---|
| 資金援助 |  韓国, 1件 韓国, 1件 | 組織 | 認可番号 | 国 |
|---|
| National Research Foundation (NRF, Korea) | 2015R1D1A1A01058942 |  韓国 韓国 |
|
|---|
 引用 引用 |  ジャーナル: To Be Published ジャーナル: To Be Published
タイトル: The crystal structure of plasma-derived human serum albumin
著者: Park, J. / Kim, M.S. / Shin, D.H. |
|---|
| 履歴 | | 登録 | 2017年12月19日 | 登録サイト: PDBJ / 処理サイト: PDBJ |
|---|
| 改定 1.0 | 2018年12月19日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 2.0 | 2020年6月24日 | Group: Advisory / Atomic model ...Advisory / Atomic model / Author supporting evidence / Data collection / Derived calculations / Non-polymer description / Other / Refinement description / Structure summary
カテゴリ: atom_site / atom_site_anisotrop ...atom_site / atom_site_anisotrop / cell / chem_comp / computing / diffrn / entity / pdbx_audit_support / pdbx_entity_instance_feature / pdbx_entity_nonpoly / pdbx_entry_details / pdbx_nonpoly_scheme / pdbx_refine_tls / pdbx_refine_tls_group / pdbx_struct_assembly_gen / pdbx_struct_assembly_prop / pdbx_validate_close_contact / pdbx_validate_symm_contact / pdbx_validate_torsion / refine / refine_hist / refine_ls_restr / refine_ls_shell / reflns / software / struct_asym / struct_conf / struct_conn / struct_mon_prot_cis / struct_site / struct_site_gen / symmetry
Item: _cell.angle_beta / _cell.volume ..._cell.angle_beta / _cell.volume / _chem_comp.formula / _chem_comp.formula_weight / _chem_comp.id / _chem_comp.mon_nstd_flag / _chem_comp.name / _chem_comp.pdbx_synonyms / _chem_comp.type / _diffrn.pdbx_serial_crystal_experiment / _pdbx_audit_support.funding_organization / _pdbx_struct_assembly_gen.asym_id_list / _pdbx_struct_assembly_prop.value / _pdbx_validate_symm_contact.auth_asym_id_1 / _pdbx_validate_symm_contact.auth_asym_id_2 / _pdbx_validate_symm_contact.auth_atom_id_1 / _pdbx_validate_symm_contact.auth_atom_id_2 / _pdbx_validate_symm_contact.auth_comp_id_1 / _pdbx_validate_symm_contact.auth_comp_id_2 / _pdbx_validate_symm_contact.auth_seq_id_1 / _pdbx_validate_symm_contact.auth_seq_id_2 / _pdbx_validate_symm_contact.dist / _pdbx_validate_symm_contact.site_symmetry_2 / _refine.B_iso_mean / _refine.ls_R_factor_R_free / _refine.ls_R_factor_R_work / _refine.ls_R_factor_obs / _refine.ls_d_res_high / _refine.ls_number_reflns_R_work / _refine.ls_number_reflns_all / _refine.overall_SU_ML / _refine.pdbx_overall_phase_error / _refine.pdbx_stereochemistry_target_values / _refine.solvent_model_details / _refine_hist.d_res_high / _refine_hist.number_atoms_solvent / _refine_hist.number_atoms_total / _refine_hist.pdbx_number_atoms_ligand / _refine_ls_restr.dev_ideal / _refine_ls_restr.number / _refine_ls_restr.type / _refine_ls_shell.R_factor_R_free / _refine_ls_shell.R_factor_R_work / _refine_ls_shell.d_res_high / _refine_ls_shell.d_res_low / _refine_ls_shell.number_reflns_R_free / _refine_ls_shell.number_reflns_R_work / _refine_ls_shell.percent_reflns_obs / _reflns.B_iso_Wilson_estimate / _software.version / _struct_mon_prot_cis.pdbx_omega_angle / _symmetry.space_group_name_Hall
解説: Ligand geometry
詳細: We have replaced several fatty acid ligands with longer fatty acids, re-modeled the ligand geometry, and refined the overall protein structure.
Provider: author / タイプ: Coordinate replacement |
|---|
| 改定 2.1 | 2023年11月22日 | Group: Data collection / Database references / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
| 改定 2.2 | 2024年10月23日 | Group: Structure summary
カテゴリ: pdbx_entry_details / pdbx_modification_feature
Item: _pdbx_entry_details.has_protein_modification |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2.17 Å
分子置換 / 解像度: 2.17 Å  データ登録者
データ登録者 韓国, 1件
韓国, 1件  引用
引用 ジャーナル: To Be Published
ジャーナル: To Be Published 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 5z0b.cif.gz
5z0b.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb5z0b.ent.gz
pdb5z0b.ent.gz PDB形式
PDB形式 5z0b.json.gz
5z0b.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 5z0b_validation.pdf.gz
5z0b_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 5z0b_full_validation.pdf.gz
5z0b_full_validation.pdf.gz 5z0b_validation.xml.gz
5z0b_validation.xml.gz 5z0b_validation.cif.gz
5z0b_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/z0/5z0b
https://data.pdbj.org/pub/pdb/validation_reports/z0/5z0b ftp://data.pdbj.org/pub/pdb/validation_reports/z0/5z0b
ftp://data.pdbj.org/pub/pdb/validation_reports/z0/5z0b
 リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 参照: UniProt: P02768
Homo sapiens (ヒト) / 参照: UniProt: P02768
















 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  Australian Synchrotron
Australian Synchrotron  / ビームライン: MX1 / 波長: 0.9536 Å
/ ビームライン: MX1 / 波長: 0.9536 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj


























