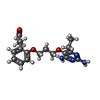
| ソフトウェア | | 名称 | バージョン | 分類 |
|---|
| XSCALE | | データスケーリング | | PHENIX | (phenix.refine: dev_1615)| 精密化 | | PDB_EXTRACT | 3.22 | データ抽出 | | XDS | | データ削減 | | PHASER | | 位相決定 | |
|
|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換
開始モデル: 1df7
解像度: 2.3→50 Å / SU ML: 0.22 / 交差検証法: FREE R-VALUE / σ(F): 1.37 / 位相誤差: 25.08
| Rfactor | 反射数 | %反射 |
|---|
| Rfree | 0.2274 | 542 | 5.53 % |
|---|
| Rwork | 0.1786 | - | - |
|---|
| obs | 0.1814 | 9803 | 99.88 % |
|---|
|
|---|
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.11 Å |
|---|
| 原子変位パラメータ | Biso max: 129.34 Å2 / Biso mean: 57.14 Å2 / Biso min: 27.15 Å2 |
|---|
| 精密化ステップ | サイクル: final / 解像度: 2.3→50 Å
| タンパク質 | 核酸 | リガンド | 溶媒 | 全体 |
|---|
| 原子数 | 1198 | 0 | 45 | 29 | 1272 |
|---|
| Biso mean | - | - | 55.12 | 48.26 | - |
|---|
| 残基数 | - | - | - | - | 161 |
|---|
|
|---|
| 拘束条件 | | Refine-ID | タイプ | Dev ideal | 数 |
|---|
| X-RAY DIFFRACTION | f_bond_d| 0.007 | 1271 | | X-RAY DIFFRACTION | f_angle_d| 0.911 | 1737 | | X-RAY DIFFRACTION | f_chiral_restr| 0.036 | 187 | | X-RAY DIFFRACTION | f_plane_restr| 0.005 | 221 | | X-RAY DIFFRACTION | f_dihedral_angle_d| 12.426 | 433 | | | | | |
|
|---|
| LS精密化 シェル | Refine-ID: X-RAY DIFFRACTION / Rfactor Rfree error: 0 / % reflection obs: 100 % | 解像度 (Å) | Rfactor Rfree | Num. reflection Rfree | Rfactor Rwork | Num. reflection Rwork |
|---|
| 2.3001-2.5315 | 0.2668 | 106 | 0.2247 | 2288 | | 2.5315-2.8978 | 0.2337 | 162 | 0.2075 | 2252 | | 2.8978-3.6507 | 0.2477 | 132 | 0.1914 | 2308 | | 3.6507-50 | 0.2109 | 142 | 0.1583 | 2413 |
|
|---|
| 精密化 TLS | 手法: refined / Refine-ID: X-RAY DIFFRACTION | ID | L11 (°2) | L12 (°2) | L13 (°2) | L22 (°2) | L23 (°2) | L33 (°2) | S11 (Å °) | S12 (Å °) | S13 (Å °) | S21 (Å °) | S22 (Å °) | S23 (Å °) | S31 (Å °) | S32 (Å °) | S33 (Å °) | T11 (Å2) | T12 (Å2) | T13 (Å2) | T22 (Å2) | T23 (Å2) | T33 (Å2) | Origin x (Å) | Origin y (Å) | Origin z (Å) |
|---|
| 1 | 2.7307 | -0.4647 | -0.1317 | 1.861 | 0.7251 | 2.9169 | 0.2238 | -0.1802 | 0.103 | 0.3955 | -0.0306 | -0.1126 | 0.1678 | -0.1473 | -0.2003 | 0.3619 | -0.0892 | -0.0193 | 0.2781 | -0.0182 | 0.3304 | 20.8634 | -23.0785 | -6.3324 | | 2 | 1.4612 | 0.0805 | 0.5424 | 3.6394 | -2.6452 | 8.298 | 0.0713 | 0.0703 | -0.4652 | 0.1501 | 0.1262 | -0.0579 | 1.8264 | -0.1633 | -0.1743 | 0.6243 | -0.0317 | -0.0775 | 0.334 | -0.0469 | 0.4451 | 25.5202 | -31.2864 | -3.7233 | | 3 | 8.2344 | 0.7155 | -1.4741 | 2.3158 | -2.5284 | 4.6702 | -0.2404 | 0.6134 | -2.1448 | -0.4095 | 0.2913 | -0.4919 | 1.8779 | -0.4169 | -0.0377 | 1.161 | -0.1141 | -0.0509 | 0.5016 | -0.0834 | 0.8015 | 23.6018 | -38.7063 | -4.0722 | | 4 | 7.3735 | 1.1172 | 0.2236 | 6.875 | 1.3486 | 5.5033 | 0.5012 | -0.5817 | -1.1428 | 0.3884 | -0.5102 | 0.056 | 1.5426 | -0.4621 | -0.1867 | 1.074 | -0.0972 | -0.1293 | 0.5744 | 0.1924 | 0.6376 | 21.2516 | -37.2528 | 8.3665 | | 5 | 8.9235 | 0.1221 | -5.0431 | 7.1606 | 4.8917 | 6.3539 | 0.302 | -2.2294 | 0.3489 | -0.3083 | 0.7306 | 0.11 | -0.3089 | 1.784 | -0.2563 | 1.426 | -0.3234 | -0.2942 | 0.9769 | 0.2636 | 0.4814 | 26.8235 | -31.6515 | 12.3245 | | 6 | 2.5021 | 1.1974 | 0.4383 | 2.8957 | 1.3612 | 6.9357 | 0.2049 | -0.3281 | -0.1028 | 0.5795 | 0.0247 | -0.0088 | 0.1533 | 0.609 | -0.237 | 0.4323 | -0.0898 | -0.012 | 0.3086 | -0.0556 | 0.345 | 26.9175 | -21.9791 | 1.7711 | | 7 | 6.837 | 3.063 | -5.0245 | 3.0173 | -3.0469 | 4.1298 | 1.187 | 0.8861 | 1.5142 | 0.884 | 0.5486 | 1.9395 | -0.9891 | -1.7214 | -1.6829 | 0.5427 | 0.0533 | 0.1115 | 0.6988 | 0.0875 | 0.9292 | 10.5643 | -18.1606 | -10.2141 | | 8 | 1.2507 | 1.1808 | 2.5301 | 5.2539 | 2.3792 | 5.3183 | -0.5015 | 0.5408 | 0.2442 | -0.3342 | 0.4776 | -0.2923 | -0.4039 | 0.7058 | 0.0603 | 0.5408 | -0.173 | 0.0311 | 0.4087 | -0.0277 | 0.3502 | 26.7199 | -11.5583 | -0.9774 | | 9 | 2.5586 | -0.2707 | -0.9229 | 1.7076 | -1.9338 | 4.8486 | -0.2275 | -0.1025 | 0.3693 | -0.3905 | -0.1893 | -0.1743 | -1.4977 | 0.2012 | 0.1379 | 0.3466 | -0.064 | 0.0571 | 0.421 | -0.0786 | 0.3724 | 27.9496 | -17.2446 | -13.8294 |
|
|---|
| 精密化 TLSグループ | | ID | Refine-ID | Refine TLS-ID | Selection details | Auth asym-ID | Auth seq-ID |
|---|
| 1 | X-RAY DIFFRACTION | 1 | chain 'A' and (resid -1 through 24 ) | A| -1 - 24 | | 2 | X-RAY DIFFRACTION | 2 | chain 'A' and (resid 25 through 49 )A| 25 - 49 | | 3 | X-RAY DIFFRACTION | 3 | chain 'A' and (resid 50 through 60 )A| 50 - 60 | | 4 | X-RAY DIFFRACTION | 4 | chain 'A' and (resid 61 through 76 )A| 61 - 76 | | 5 | X-RAY DIFFRACTION | 5 | chain 'A' and (resid 77 through 87 )A| 77 - 87 | | 6 | X-RAY DIFFRACTION | 6 | chain 'A' and (resid 88 through 115 )A| 88 - 115 | | 7 | X-RAY DIFFRACTION | 7 | chain 'A' and (resid 116 through 125 )A| 116 - 125 | | 8 | X-RAY DIFFRACTION | 8 | chain 'A' and (resid 126 through 139 )A| 126 - 139 | | 9 | X-RAY DIFFRACTION | 9 | chain 'A' and (resid 140 through 159 )A| 140 - 159 | | | | | | | | | | | | | | | | | |
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2.3 Å
分子置換 / 解像度: 2.3 Å  データ登録者
データ登録者 引用
引用 ジャーナル: TO BE PUBLISHED
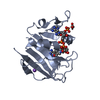
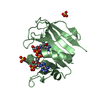
ジャーナル: TO BE PUBLISHED 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 5ujf.cif.gz
5ujf.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb5ujf.ent.gz
pdb5ujf.ent.gz PDB形式
PDB形式 5ujf.json.gz
5ujf.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 5ujf_validation.pdf.gz
5ujf_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 5ujf_full_validation.pdf.gz
5ujf_full_validation.pdf.gz 5ujf_validation.xml.gz
5ujf_validation.xml.gz 5ujf_validation.cif.gz
5ujf_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/uj/5ujf
https://data.pdbj.org/pub/pdb/validation_reports/uj/5ujf ftp://data.pdbj.org/pub/pdb/validation_reports/uj/5ujf
ftp://data.pdbj.org/pub/pdb/validation_reports/uj/5ujf
 リンク
リンク 集合体
集合体

 要素
要素 Mycobacterium tuberculosis (strain ATCC 25618 / H37Rv) (結核菌)
Mycobacterium tuberculosis (strain ATCC 25618 / H37Rv) (結核菌)
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  APS
APS  / ビームライン: 21-ID-F / 波長: 0.97872 Å
/ ビームライン: 21-ID-F / 波長: 0.97872 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj