| 登録情報 | データベース: PDB / ID: 5to8
|
|---|
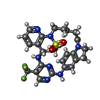
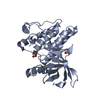
| タイトル | Selectivity switch between FAK and Pyk2: Macrocyclization of FAK inhibitors improves Pyk2 potency |
|---|
 要素 要素 | Protein-tyrosine kinase 2-beta |
|---|
 キーワード キーワード | Transferase/Transferase Inhibitor / kinase / Transferase-Transferase Inhibitor complex |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
regulation of macrophage chemotaxis / neurotransmitter receptor regulator activity / positive regulation of B cell chemotaxis / marginal zone B cell differentiation / regulation of ubiquitin-dependent protein catabolic process / endothelin receptor signaling pathway / negative regulation of myeloid cell differentiation / negative regulation of bone mineralization / cortical cytoskeleton organization / regulation of postsynaptic density assembly ...regulation of macrophage chemotaxis / neurotransmitter receptor regulator activity / positive regulation of B cell chemotaxis / marginal zone B cell differentiation / regulation of ubiquitin-dependent protein catabolic process / endothelin receptor signaling pathway / negative regulation of myeloid cell differentiation / negative regulation of bone mineralization / cortical cytoskeleton organization / regulation of postsynaptic density assembly / activation of Janus kinase activity / chemokine-mediated signaling pathway / apical dendrite / cellular response to fluid shear stress / regulation of release of sequestered calcium ion into cytosol / signal complex assembly / positive regulation of ubiquitin-dependent protein catabolic process / calcium/calmodulin-dependent protein kinase activity / sprouting angiogenesis / Interleukin-2 signaling / Signal regulatory protein family interactions / NMDA selective glutamate receptor complex / peptidyl-tyrosine autophosphorylation / positive regulation of cell-matrix adhesion / positive regulation of actin filament polymerization / Golgi organization / negative regulation of potassium ion transport / positive regulation of protein kinase activity / RHOU GTPase cycle / signaling receptor activator activity / positive regulation of excitatory postsynaptic potential / vascular endothelial growth factor receptor signaling pathway / bone resorption / positive regulation of synaptic transmission, glutamatergic / postsynaptic density, intracellular component / cellular defense response / regulation of cell adhesion / cellular response to retinoic acid / ionotropic glutamate receptor binding / positive regulation of endothelial cell migration / ionotropic glutamate receptor signaling pathway / peptidyl-tyrosine phosphorylation / tumor necrosis factor-mediated signaling pathway / integrin-mediated signaling pathway / regulation of actin cytoskeleton organization / non-membrane spanning protein tyrosine kinase activity / positive regulation of JNK cascade / non-specific protein-tyrosine kinase / positive regulation of neuron projection development / regulation of synaptic plasticity / VEGFA-VEGFR2 Pathway / long-term synaptic potentiation / epidermal growth factor receptor signaling pathway / neuron migration / positive regulation of angiogenesis / presynapse / lamellipodium / regulation of cell shape / growth cone / cell body / protein autophosphorylation / protein-containing complex assembly / protein tyrosine kinase activity / cell cortex / adaptive immune response / negative regulation of neuron apoptotic process / cytoskeleton / cell surface receptor signaling pathway / positive regulation of ERK1 and ERK2 cascade / protein phosphorylation / positive regulation of phosphatidylinositol 3-kinase/protein kinase B signal transduction / postsynaptic density / positive regulation of cell migration / negative regulation of cell population proliferation / focal adhesion / neuronal cell body / positive regulation of cell population proliferation / apoptotic process / dendrite / negative regulation of apoptotic process / perinuclear region of cytoplasm / glutamatergic synapse / signal transduction / ATP binding / nucleus / plasma membrane / cytosol / cytoplasm類似検索 - 分子機能 Focal adhesion kinase, targeting (FAT) domain / Focal adhesion kinase, targeting (FAT) domain superfamily / Focal adhesion kinase, N-terminal / FAK1/PYK2, FERM domain C-lobe / Focal adhesion targeting region / FERM N-terminal domain / : / FAK1/PYK2, FERM domain C-lobe / FERM central domain / FERM/acyl-CoA-binding protein superfamily ...Focal adhesion kinase, targeting (FAT) domain / Focal adhesion kinase, targeting (FAT) domain superfamily / Focal adhesion kinase, N-terminal / FAK1/PYK2, FERM domain C-lobe / Focal adhesion targeting region / FERM N-terminal domain / : / FAK1/PYK2, FERM domain C-lobe / FERM central domain / FERM/acyl-CoA-binding protein superfamily / FERM central domain / FERM superfamily, second domain / FERM domain / FERM domain profile. / Band 4.1 domain / Band 4.1 homologues / Tyrosine-protein kinase, catalytic domain / Tyrosine kinase, catalytic domain / Tyrosine protein kinases specific active-site signature. / PH-like domain superfamily / Tyrosine-protein kinase, active site / Serine-threonine/tyrosine-protein kinase, catalytic domain / Protein tyrosine and serine/threonine kinase / Ubiquitin-like domain superfamily / Phosphorylase Kinase; domain 1 / Phosphorylase Kinase; domain 1 / Transferase(Phosphotransferase) domain 1 / Transferase(Phosphotransferase); domain 1 / Protein kinase, ATP binding site / Protein kinases ATP-binding region signature. / Protein kinase domain profile. / Protein kinase domain / Protein kinase-like domain superfamily / 2-Layer Sandwich / Orthogonal Bundle / Mainly Alpha / Alpha Beta類似検索 - ドメイン・相同性 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / 解像度: 1.9849 Å シンクロトロン / 解像度: 1.9849 Å |
|---|
 データ登録者 データ登録者 | Newby, Z.E. |
|---|
 引用 引用 |  ジャーナル: Bioorg. Med. Chem. Lett. / 年: 2016 ジャーナル: Bioorg. Med. Chem. Lett. / 年: 2016
タイトル: Selectivity switch between FAK and Pyk2: Macrocyclization of FAK inhibitors improves Pyk2 potency.
著者: Farand, J. / Mai, N. / Chandrasekhar, J. / Newby, Z.E. / Van Veldhuizen, J. / Loyer-Drew, J. / Venkataramani, C. / Guerrero, J. / Kwok, A. / Li, N. / Zherebina, Y. / Wilbert, S. / Zablocki, J. ...著者: Farand, J. / Mai, N. / Chandrasekhar, J. / Newby, Z.E. / Van Veldhuizen, J. / Loyer-Drew, J. / Venkataramani, C. / Guerrero, J. / Kwok, A. / Li, N. / Zherebina, Y. / Wilbert, S. / Zablocki, J. / Phillips, G. / Watkins, W.J. / Mourey, R. / Notte, G.T. |
|---|
| 履歴 | | 登録 | 2016年10月17日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2016年12月21日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2024年3月6日 | Group: Data collection / Database references / カテゴリ: chem_comp_atom / chem_comp_bond / database_2
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン / 解像度: 1.9849 Å
シンクロトロン / 解像度: 1.9849 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Bioorg. Med. Chem. Lett. / 年: 2016
ジャーナル: Bioorg. Med. Chem. Lett. / 年: 2016 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 5to8.cif.gz
5to8.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb5to8.ent.gz
pdb5to8.ent.gz PDB形式
PDB形式 5to8.json.gz
5to8.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 5to8_validation.pdf.gz
5to8_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 5to8_full_validation.pdf.gz
5to8_full_validation.pdf.gz 5to8_validation.xml.gz
5to8_validation.xml.gz 5to8_validation.cif.gz
5to8_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/to/5to8
https://data.pdbj.org/pub/pdb/validation_reports/to/5to8 ftp://data.pdbj.org/pub/pdb/validation_reports/to/5to8
ftp://data.pdbj.org/pub/pdb/validation_reports/to/5to8 リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 遺伝子: PTK2B, FAK2, PYK2, RAFTK / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: PTK2B, FAK2, PYK2, RAFTK / 発現宿主: 
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  ALS
ALS  / ビームライン: 5.0.2 / 波長: 1 Å
/ ビームライン: 5.0.2 / 波長: 1 Å 解析
解析 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj