+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 5o0m | ||||||
|---|---|---|---|---|---|---|---|
| Title | Deglycosylated Nogo Receptor with native disulfide structure 3 | ||||||
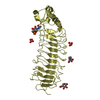
 Components Components | Reticulon-4 receptor | ||||||
 Keywords Keywords | SIGNALING PROTEIN / nervous system / signaling / leucine-rich repeat domain / disulfide structure | ||||||
| Function / homology |  Function and homology information Function and homology informationneuronal signal transduction / ganglioside GM1 binding / chondroitin sulfate binding / neuregulin receptor activity / negative regulation of axon regeneration / ganglioside GT1b binding / negative regulation of axon extension / corpus callosum development / regulation of synapse assembly / positive regulation of Rho protein signal transduction ...neuronal signal transduction / ganglioside GM1 binding / chondroitin sulfate binding / neuregulin receptor activity / negative regulation of axon regeneration / ganglioside GT1b binding / negative regulation of axon extension / corpus callosum development / regulation of synapse assembly / positive regulation of Rho protein signal transduction / regulation of postsynapse assembly / positive regulation of GTPase activity / axonal growth cone / axonogenesis / dendritic shaft / heparin binding / negative regulation of neuron projection development / growth cone / perikaryon / cell surface receptor signaling pathway / neuron projection / membrane raft / external side of plasma membrane / neuronal cell body / glutamatergic synapse / cell surface / endoplasmic reticulum / plasma membrane Similarity search - Function | ||||||
| Biological species |  | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 1.9 Å MOLECULAR REPLACEMENT / Resolution: 1.9 Å | ||||||
 Authors Authors | Pronker, M.F. / Janssen, B.J.C. | ||||||
| Funding support |  Netherlands, 1items Netherlands, 1items
| ||||||
 Citation Citation |  Journal: Acta Crystallogr D Struct Biol / Year: 2017 Journal: Acta Crystallogr D Struct Biol / Year: 2017Title: Nogo Receptor crystal structures with a native disulfide pattern suggest a novel mode of self-interaction. Authors: Pronker, M.F. / Tas, R.P. / Vlieg, H.C. / Janssen, B.J.C. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  5o0m.cif.gz 5o0m.cif.gz | 353.3 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb5o0m.ent.gz pdb5o0m.ent.gz | 294.9 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  5o0m.json.gz 5o0m.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/o0/5o0m https://data.pdbj.org/pub/pdb/validation_reports/o0/5o0m ftp://data.pdbj.org/pub/pdb/validation_reports/o0/5o0m ftp://data.pdbj.org/pub/pdb/validation_reports/o0/5o0m | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  5o0kC  5o0lC  5o0nC  5o0oC  5o0pC  5o0qC  5o0rC  1oznS S: Starting model for refinement C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| Unit cell |
|
- Components
Components
| #1: Protein | Mass: 36011.207 Da / Num. of mol.: 2 Source method: isolated from a genetically manipulated source Source: (gene. exp.)   Homo sapiens (human) / Variant (production host): GntI-/- / References: UniProt: Q99PI8 Homo sapiens (human) / Variant (production host): GntI-/- / References: UniProt: Q99PI8#2: Sugar | ChemComp-NAG / #3: Water | ChemComp-HOH / | Has protein modification | Y | |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.09 Å3/Da / Density % sol: 41.08 % |
|---|---|
| Crystal grow | Temperature: 291 K / Method: vapor diffusion, sitting drop / pH: 5 / Details: 0.05 M MIB buffer pH 5.0, 12.5% PEG1500 |
-Data collection
| Diffraction | Mean temperature: 100 K |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  NSLS NSLS  / Beamline: X6A / Wavelength: 0.9999 Å / Beamline: X6A / Wavelength: 0.9999 Å |
| Detector | Type: DECTRIS PILATUS 6M-F / Detector: PIXEL / Date: Aug 22, 2013 |
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 0.9999 Å / Relative weight: 1 |
| Reflection | Resolution: 1.9→56.03 Å / Num. obs: 48250 / % possible obs: 99.7 % / Redundancy: 4.6 % / CC1/2: 0.994 / Rsym value: 0.129 / Net I/σ(I): 6 |
| Reflection shell | Resolution: 1.9→1.94 Å / Redundancy: 4.7 % / Mean I/σ(I) obs: 1.5 / CC1/2: 0.503 / Rsym value: 1.054 / % possible all: 99.8 |
- Processing
Processing
| Software |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: 1OZN Resolution: 1.9→56.03 Å / SU ML: 0.22 / Cross valid method: FREE R-VALUE / σ(F): 1.33 / Phase error: 23.67
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Shrinkage radii: 0.9 Å / VDW probe radii: 1.11 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 1.9→56.03 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller












 PDBj
PDBj







