+ データを開く
データを開く
- 基本情報
基本情報
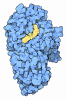
| 登録情報 | データベース: PDB / ID: 5ii5 | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Crystal structure of red abalone VERL repeat 1 at 1.8 A resolution | |||||||||||||||||||||
 要素 要素 | Maltose-binding periplasmic protein,Vitelline envelope sperm lysin receptor | |||||||||||||||||||||
 キーワード キーワード | CELL ADHESION / FERTILIZATION / EGG-SPERM INTERACTION / GAMETE RECOGNITION / VITELLINE ENVELOPE / SPERM RECEPTOR | |||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報vitelline envelope / sperm-egg recognition / detection of maltose stimulus / maltose transport complex / carbohydrate transport / carbohydrate transmembrane transporter activity / maltose binding / maltose transport / maltodextrin transmembrane transport / ATP-binding cassette (ABC) transporter complex, substrate-binding subunit-containing ...vitelline envelope / sperm-egg recognition / detection of maltose stimulus / maltose transport complex / carbohydrate transport / carbohydrate transmembrane transporter activity / maltose binding / maltose transport / maltodextrin transmembrane transport / ATP-binding cassette (ABC) transporter complex, substrate-binding subunit-containing / ATP-binding cassette (ABC) transporter complex / cell chemotaxis / outer membrane-bounded periplasmic space / periplasmic space / DNA damage response / extracellular region / membrane / plasma membrane 類似検索 - 分子機能 | |||||||||||||||||||||
| 生物種 |   Haliotis rufescens (無脊椎動物) Haliotis rufescens (無脊椎動物) | |||||||||||||||||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.8 Å 分子置換 / 解像度: 1.8 Å | |||||||||||||||||||||
 データ登録者 データ登録者 | Sadat Al-Hosseini, H. / Raj, I. / Nishimura, K. / Jovine, L. | |||||||||||||||||||||
| 資金援助 |  スウェーデン, 6件 スウェーデン, 6件
| |||||||||||||||||||||
 引用 引用 |  ジャーナル: Cell / 年: 2017 ジャーナル: Cell / 年: 2017タイトル: Structural Basis of Egg Coat-Sperm Recognition at Fertilization. 著者: Raj, I. / Sadat Al Hosseini, H. / Dioguardi, E. / Nishimura, K. / Han, L. / Villa, A. / de Sanctis, D. / Jovine, L. #1: ジャーナル: Mol. Biol. Evol. / 年: 2011 タイトル: The molecular basis of sex: linking yeast to human. 著者: Swanson, W.J. / Aagaard, J.E. / Vacquier, V.D. / Monne, M. / Sadat Al Hosseini, H. / Jovine, L. #2: ジャーナル: Proc. Natl. Acad. Sci. U.S.A. / 年: 2006 タイトル: Rapidly evolving zona pellucida domain proteins are a major component of the vitelline envelope of abalone eggs. 著者: Aagaard, J.E. / Yi, X. / MacCoss, M.J. / Swanson, W.J. #3: ジャーナル: Gene / 年: 2002 タイトル: Full-length sequence of VERL, the egg vitelline envelope receptor for abalone sperm lysin. 著者: Galindo, B.E. / Moy, G.W. / Swanson, W.J. / Vacquier, V.D. #4: ジャーナル: Proc. Natl. Acad. Sci. U.S.A. / 年: 1997 タイトル: The abalone egg vitelline envelope receptor for sperm lysin is a giant multivalent molecule. 著者: Swanson, W.J. / Vacquier, V.D. | |||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  5ii5.cif.gz 5ii5.cif.gz | 292.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb5ii5.ent.gz pdb5ii5.ent.gz | 239.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  5ii5.json.gz 5ii5.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  5ii5_validation.pdf.gz 5ii5_validation.pdf.gz | 871.4 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  5ii5_full_validation.pdf.gz 5ii5_full_validation.pdf.gz | 875.8 KB | 表示 | |
| XML形式データ |  5ii5_validation.xml.gz 5ii5_validation.xml.gz | 21.1 KB | 表示 | |
| CIF形式データ |  5ii5_validation.cif.gz 5ii5_validation.cif.gz | 30.2 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ii/5ii5 https://data.pdbj.org/pub/pdb/validation_reports/ii/5ii5 ftp://data.pdbj.org/pub/pdb/validation_reports/ii/5ii5 ftp://data.pdbj.org/pub/pdb/validation_reports/ii/5ii5 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  5ii4C  5ii6C  5ii7C  5ii8C  5ii9C  5iiaC  5iibC  5iicC  5mr2C  5mr3C  3setS  3sexS  4wrnS C: 同じ文献を引用 ( S: 精密化の開始モデル |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 54471.543 Da / 分子数: 1 変異: N4115Q, N4122T, N4142Y,N4115Q, N4122T, N4142Y,N4115Q, N4122T, N4142Y,N4115Q, N4122T, N4142Y 由来タイプ: 組換発現 詳細: THIS PROTEIN IS A CHIMERA. RESIDUES 3667-4034 ARE FROM E. COLI MALTOSE BINDING PROTEIN (MBP), CORRESPOND TO RESIDUES 26-393 OF SWISS-PROT DATABASE ENTRY P0AEX9 AND CONTAIN MUTATIONS A3667T, ...詳細: THIS PROTEIN IS A CHIMERA. RESIDUES 3667-4034 ARE FROM E. COLI MALTOSE BINDING PROTEIN (MBP), CORRESPOND TO RESIDUES 26-393 OF SWISS-PROT DATABASE ENTRY P0AEX9 AND CONTAIN MUTATIONS A3667T, D3749A, K3750A, E3839A, N3840A, A3882H, K3886H, K3906A, A3979V, I3984V, E4026A, E4029A, D4030A AND R4034N (CORRESPONDING TO A26T, D108A, K109A, E198A, N199A, A241H, K245H, K265A, A338V, I343V, E385A, E388A, D389A AND R393N IN P0AEX9). RESIDUES 4038-4151 ARE FROM RED ABALONE VITELLINE ENVELOPE SPERM LYSIN RECEPTOR AND CORRESPOND TO RESIDUES 38-151 OF SWISS-PROT DATABASE ENTRY Q8WR62 AND CONTAIN MUTATIONS N4115Q, N4122T AND N4142Y (CORRESPONDING TO N115Q, N122T AND N142Y). 由来: (組換発現)   Haliotis rufescens (無脊椎動物) Haliotis rufescens (無脊椎動物)株: K12 / 遺伝子: malE, b4034, JW3994, VERL / プラスミド: pHLsec / 細胞株 (発現宿主): HEK293 / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: P0AEX9, UniProt: Q8WR62 Homo sapiens (ヒト) / 参照: UniProt: P0AEX9, UniProt: Q8WR62 | ||||
|---|---|---|---|---|---|
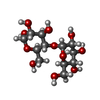
| #2: 多糖 | alpha-D-glucopyranose-(1-4)-alpha-D-glucopyranose / alpha-maltose | ||||
| #3: 化合物 | ChemComp-PGE / 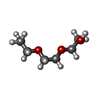  分子量: 150.173 Da / 分子数: 4 / 変異: N4115Q, N4122T, N4142Y / 由来タイプ: 組換発現 / 式: C6H14O4 分子量: 150.173 Da / 分子数: 4 / 変異: N4115Q, N4122T, N4142Y / 由来タイプ: 組換発現 / 式: C6H14O4詳細: THIS PROTEIN IS A CHIMERA. RESIDUES 3667-4034 ARE FROM E. COLI MALTOSE BINDING PROTEIN (MBP), CORRESPOND TO RESIDUES 26-393 OF SWISS-PROT DATABASE ENTRY P0AEX9 AND CONTAIN MUTATIONS A3667T, ...詳細: THIS PROTEIN IS A CHIMERA. RESIDUES 3667-4034 ARE FROM E. COLI MALTOSE BINDING PROTEIN (MBP), CORRESPOND TO RESIDUES 26-393 OF SWISS-PROT DATABASE ENTRY P0AEX9 AND CONTAIN MUTATIONS A3667T, D3749A, K3750A, E3839A, N3840A, A3882H, K3886H, K3906A, A3979V, I3984V, E4026A, E4029A, D4030A AND R4034N (CORRESPONDING TO A26T, D108A, K109A, E198A, N199A, A241H, K245H, K265A, A338V, I343V, E385A, E388A, D389A AND R393N IN P0AEX9). RESIDUES 4038-4151 ARE FROM RED ABALONE VITELLINE ENVELOPE SPERM LYSIN RECEPTOR AND CORRESPOND TO RESIDUES 38-151 OF SWISS-PROT DATABASE ENTRY Q8WR62 AND CONTAIN MUTATIONS N4115Q, N4122T AND N4142Y (CORRESPONDING TO N115Q, N122T AND N142Y). 由来: (組換発現)   Homo sapiens (ヒト) Homo sapiens (ヒト)#4: 水 | ChemComp-HOH / | Has protein modification | Y | |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.99 Å3/Da / 溶媒含有率: 58.9 % |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 9.5 / 詳細: 40% PEG 600, 0.1M CHES |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  ESRF ESRF  / ビームライン: ID29 / 波長: 0.97625 Å / ビームライン: ID29 / 波長: 0.97625 Å |
| 検出器 | タイプ: DECTRIS PILATUS 6M-F / 検出器: PIXEL / 日付: 2014年9月10日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.97625 Å / 相対比: 1 |
| 反射 | 解像度: 1.8→37.837 Å / Num. obs: 61781 / % possible obs: 99 % / 冗長度: 5.9 % / Biso Wilson estimate: 33.37 Å2 / CC1/2: 1 / Rmerge(I) obs: 0.04992 / Net I/σ(I): 17.51 |
| 反射 シェル | 解像度: 1.8→1.864 Å / 冗長度: 5.9 % / Rmerge(I) obs: 1.538 / Mean I/σ(I) obs: 1.08 / % possible all: 99 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 3SET, 3SEX and 4WRN 解像度: 1.8→37.837 Å / SU ML: 0.24 / 交差検証法: FREE R-VALUE / σ(F): 1.38 / 位相誤差: 27.38 / 立体化学のターゲット値: ML
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.8 Å / VDWプローブ半径: 1.1 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.8→37.837 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 手法: refined / Refine-ID: X-RAY DIFFRACTION
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ |
|
 ムービー
ムービー コントローラー
コントローラー


















 PDBj
PDBj