[English] 日本語
 Yorodumi
Yorodumi- PDB-5fps: Structure of hepatitis C virus (HCV) full-length NS3 complex with... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 5fps | ||||||
|---|---|---|---|---|---|---|---|
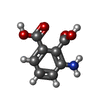
| Title | Structure of hepatitis C virus (HCV) full-length NS3 complex with small-molecule ligand 3-aminobenzene-1,2-dicarboxylic acid (AT1246) in an alternate binding site. | ||||||
 Components Components | HEPATITIS C VIRUS FULL-LENGTH NS3 COMPLEX | ||||||
 Keywords Keywords | HYDROLASE / HEPATITIS C VIRUS / HCV / NS3 COMPLEX / PROTEASE-HELICASE / PROTEIN-LIGAND COMPLEX / FRAGMENT SCREENING / ALTERNATE BINDING SITE / AT1246. | ||||||
| Function / homology |  Function and homology information Function and homology informationhepacivirin / host cell mitochondrial membrane / host cell lipid droplet / symbiont-mediated transformation of host cell / symbiont-mediated suppression of host TRAF-mediated signal transduction / symbiont-mediated perturbation of host cell cycle G1/S transition checkpoint / symbiont-mediated suppression of host JAK-STAT cascade via inhibition of STAT1 activity / symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of MAVS activity / SH3 domain binding / nucleoside-triphosphate phosphatase ...hepacivirin / host cell mitochondrial membrane / host cell lipid droplet / symbiont-mediated transformation of host cell / symbiont-mediated suppression of host TRAF-mediated signal transduction / symbiont-mediated perturbation of host cell cycle G1/S transition checkpoint / symbiont-mediated suppression of host JAK-STAT cascade via inhibition of STAT1 activity / symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of MAVS activity / SH3 domain binding / nucleoside-triphosphate phosphatase / channel activity / viral nucleocapsid / monoatomic ion transmembrane transport / clathrin-dependent endocytosis of virus by host cell / RNA helicase activity / Hydrolases; Acting on peptide bonds (peptidases); Cysteine endopeptidases / host cell perinuclear region of cytoplasm / host cell endoplasmic reticulum membrane / RNA helicase / symbiont-mediated suppression of host type I interferon-mediated signaling pathway / ribonucleoprotein complex / serine-type endopeptidase activity / symbiont-mediated activation of host autophagy / RNA-directed RNA polymerase / cysteine-type endopeptidase activity / viral RNA genome replication / RNA-directed RNA polymerase activity / fusion of virus membrane with host endosome membrane / viral envelope / virion attachment to host cell / host cell nucleus / host cell plasma membrane / virion membrane / structural molecule activity / ATP hydrolysis activity / proteolysis / RNA binding / zinc ion binding / ATP binding Similarity search - Function | ||||||
| Biological species |  HEPATITIS C VIRUS HEPATITIS C VIRUS | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2.68 Å MOLECULAR REPLACEMENT / Resolution: 2.68 Å | ||||||
 Authors Authors | Jhoti, H. / Ludlow, R.F. / Saini, H.K. / Tickle, I.J. / Verdonk, M. / Williams, P.A. | ||||||
 Citation Citation |  Journal: Proc.Natl.Acad.Sci.USA / Year: 2015 Journal: Proc.Natl.Acad.Sci.USA / Year: 2015Title: Detection of Secondary Binding Sites in Proteins Using Fragment Screening. Authors: Ludlow, R.F. / Verdonk, M.L. / Saini, H.K. / Tickle, I.J. / Jhoti, H. #1:  Journal: Structure / Year: 1999 Journal: Structure / Year: 1999Title: Molecular Views of Viral Polyprotein Processing Revealed by the Crystal Structure of the Hepatitis C Virus Bifunctional Protease-Helicase. Authors: Yao, N. / Reichert, P. / Taremi, S.S. / Prosise, W.W. / Weber, P.C. #2:  Journal: Nat.Chem.Biol. / Year: 2012 Journal: Nat.Chem.Biol. / Year: 2012Title: Discovery of an Allosteric Mechanism for the Regulation of Hcv Ns3 Protein Function. Authors: Saalau-Bethell, S.M. / Woodhead, A.J. / Chessari, G. / Carr, M.G. / Coyle, J. / Graham, B. / Hiscock, S.D. / Murray, C.W. / Pathuri, P. / Rich, S.J. / Richardson, C.J. / Williams, P.A. / Jhoti, H. | ||||||
| History |
| ||||||
| Remark 700 | SHEET DETERMINATION METHOD: DSSP THE SHEETS PRESENTED AS "AB" IN EACH CHAIN ON SHEET RECORDS BELOW ... SHEET DETERMINATION METHOD: DSSP THE SHEETS PRESENTED AS "AB" IN EACH CHAIN ON SHEET RECORDS BELOW IS ACTUALLY AN 6-STRANDED BARREL THIS IS REPRESENTED BY A 7-STRANDED SHEET IN WHICH THE FIRST AND LAST STRANDS ARE IDENTICAL. THE SHEETS PRESENTED AS "BB" IN EACH CHAIN ON SHEET RECORDS BELOW IS ACTUALLY AN 6-STRANDED BARREL THIS IS REPRESENTED BY A 7-STRANDED SHEET IN WHICH THE FIRST AND LAST STRANDS ARE IDENTICAL. |
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  5fps.cif.gz 5fps.cif.gz | 488.5 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb5fps.ent.gz pdb5fps.ent.gz | 400 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  5fps.json.gz 5fps.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/fp/5fps https://data.pdbj.org/pub/pdb/validation_reports/fp/5fps ftp://data.pdbj.org/pub/pdb/validation_reports/fp/5fps ftp://data.pdbj.org/pub/pdb/validation_reports/fp/5fps | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  5fp5C  5fp6C  5fpdC  5fpeC  5fpmC  5fpnC  5fpoC  5fprC  5fptC  5fpyC  1cu1S C: citing same article ( S: Starting model for refinement |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
| ||||||||
| Noncrystallographic symmetry (NCS) | NCS oper: (Code: given / Details: 1 Matrix: (-0.92214, 0.38667, -0.0123), Vector: |
- Components
Components
| #1: Protein | Mass: 70869.391 Da / Num. of mol.: 2 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  HEPATITIS C VIRUS (ISOLATE BK) / Strain: GENOTYPE 1B / Plasmid: PET17 / Production host: HEPATITIS C VIRUS (ISOLATE BK) / Strain: GENOTYPE 1B / Plasmid: PET17 / Production host:  References: UniProt: P26663, Hydrolases; Acting on peptide bonds (peptidases); Serine endopeptidases #2: Chemical | #3: Water | ChemComp-HOH / | Has protein modification | Y | Nonpolymer details | 3-AMINOBENZE | Sequence details | N-TERM HIS TAG (37). DELETION 1-2. DELETION 632-686. | |
|---|
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.68 Å3/Da / Density % sol: 53.81 % / Description: NONE |
|---|---|
| Crystal grow | pH: 6.6 Details: 10.0%V/V MPD, 0.2M MES/NAOH, 15.0%W/V PEG 6000. PROTEIN CONC. = 6 MG/ML., pH 6.6 |
-Data collection
| Diffraction | Mean temperature: 93 K |
|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  Diamond Diamond  / Beamline: I03 / Wavelength: 0.9798 / Beamline: I03 / Wavelength: 0.9798 |
| Detector | Type: ADSC QUANTUM 315 / Detector: CCD / Date: May 23, 2008 / Details: MIRRORS |
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray |
| Radiation wavelength | Wavelength: 0.9798 Å / Relative weight: 1 |
| Reflection | Resolution: 2.66→87.4 Å / Num. obs: 41080 / % possible obs: 99.5 % / Observed criterion σ(I): -3.7 / Redundancy: 3.2 % / Biso Wilson estimate: 49.83 Å2 / Rmerge(I) obs: 0.09 / Net I/σ(I): 5.7 |
| Reflection shell | Resolution: 2.66→2.7 Å / Rmerge(I) obs: 0.39 / Mean I/σ(I) obs: 2 / % possible all: 99.8 |
- Processing
Processing
| Software |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: PDB ENTRY 1CU1 Resolution: 2.68→87.37 Å / Cor.coef. Fo:Fc: 0.939 / Cor.coef. Fo:Fc free: 0.873 / Rfactor Rfree error: 0 / SU R Cruickshank DPI: 2.603 / Cross valid method: THROUGHOUT / σ(F): 0 / SU Rfree Blow DPI: 0.341 / SU Rfree Cruickshank DPI: 0.335
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 37.3 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze | Luzzati coordinate error obs: 0.26 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 2.68→87.37 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS params. | Method: refined / Refine-ID: X-RAY DIFFRACTION
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement TLS group |
|
 Movie
Movie Controller
Controller












 PDBj
PDBj