+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 5ecm | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Crystal Structure of FIN219-FIP1 complex with JA and Leu | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | LIGASE/TRANSFERASE / Jasmonate-amido synthetase / Glutathione S-transferase / Ligase-Transferase complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報jasmonoyl-L-amino acid ligase / jasmonoyl-L-amino acid ligase activity / regulation of response to red or far red light / cellular response to auxin stimulus / induced systemic resistance, jasmonic acid mediated signaling pathway / toxin catabolic process / L-leucine binding / protein adenylylation / response to mycotoxin / glutathione binding ...jasmonoyl-L-amino acid ligase / jasmonoyl-L-amino acid ligase activity / regulation of response to red or far red light / cellular response to auxin stimulus / induced systemic resistance, jasmonic acid mediated signaling pathway / toxin catabolic process / L-leucine binding / protein adenylylation / response to mycotoxin / glutathione binding / apoplast / response to UV-B / amino acid binding / response to gravity / glutathione transferase / glutathione transferase activity / glutathione metabolic process / chloroplast / enzyme binding / mitochondrion / ATP binding / nucleus / cytosol / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.6 Å 分子置換 / 解像度: 1.6 Å | ||||||
 データ登録者 データ登録者 | Chen, C.Y. / Cheng, Y.S. | ||||||
 引用 引用 |  ジャーナル: Proc. Natl. Acad. Sci. U.S.A. / 年: 2017 ジャーナル: Proc. Natl. Acad. Sci. U.S.A. / 年: 2017タイトル: Structural basis of jasmonate-amido synthetase FIN219 in complex with glutathione S-transferase FIP1 during the JA signal regulation 著者: Chen, C.Y. / Ho, S.S. / Kuo, T.Y. / Hsieh, H.L. / Cheng, Y.S. #1:  ジャーナル: Science / 年: 2012 ジャーナル: Science / 年: 2012タイトル: Structural basis for prereceptor modulation of plant hormones by GH3 proteins. 著者: Westfall, C.S. / Zubieta, C. / Herrmann, J. / Kapp, U. / Nanao, M.H. / Jez, J.M. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  5ecm.cif.gz 5ecm.cif.gz | 432.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb5ecm.ent.gz pdb5ecm.ent.gz | 342.6 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  5ecm.json.gz 5ecm.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  5ecm_validation.pdf.gz 5ecm_validation.pdf.gz | 1.4 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  5ecm_full_validation.pdf.gz 5ecm_full_validation.pdf.gz | 1.5 MB | 表示 | |
| XML形式データ |  5ecm_validation.xml.gz 5ecm_validation.xml.gz | 112.1 KB | 表示 | |
| CIF形式データ |  5ecm_validation.cif.gz 5ecm_validation.cif.gz | 161.1 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ec/5ecm https://data.pdbj.org/pub/pdb/validation_reports/ec/5ecm ftp://data.pdbj.org/pub/pdb/validation_reports/ec/5ecm ftp://data.pdbj.org/pub/pdb/validation_reports/ec/5ecm | HTTPS FTP |
-関連構造データ
| 関連構造データ |  5echC  5eciC  5eckC  5eclC  5ecnC  5ecoC  5ecpC  5ecqC  5ecrC  5ecsC  5gzzC  4eplS C: 同じ文献を引用 ( S: 精密化の開始モデル |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 単位格子 |
|
- 要素
要素
-タンパク質 , 2種, 6分子 ADBCEF
| #1: タンパク質 | 分子量: 64416.199 Da / 分子数: 2 / 由来タイプ: 組換発現 由来: (組換発現)  遺伝子: JAR1, FIN219, At2g46370, F11C10.6 / プラスミド: pGEX-4T-1 / 発現宿主:  参照: UniProt: Q9SKE2, 合成酵素; C-N結合を形成; 酸-D-アミノ酸リガーゼ(ペプチド合成) #2: タンパク質 | 分子量: 25867.312 Da / 分子数: 4 / 由来タイプ: 組換発現 由来: (組換発現)  遺伝子: GSTU20, FIP1, At1g78370, F3F9.11 / プラスミド: pRSET-B / 発現宿主:  |
|---|
-非ポリマー , 4種, 1668分子 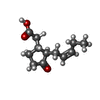

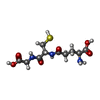




| #3: 化合物 | | #4: 化合物 | #5: 化合物 | ChemComp-GSH / #6: 水 | ChemComp-HOH / | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.27 Å3/Da / 溶媒含有率: 45.84 % |
|---|---|
| 結晶化 | 温度: 297 K / 手法: 蒸気拡散法, シッティングドロップ法 / pH: 8.5 詳細: 0.2 M sodium acetate trihydrate, 0.1 M Tris-HCl, 30%(w/v) PEG 3000 |
-データ収集
| 回折 | 平均測定温度: 100 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  NSRRC NSRRC  / ビームライン: BL13C1 / 波長: 0.9762-0.97622 / ビームライン: BL13C1 / 波長: 0.9762-0.97622 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 検出器 | タイプ: RAYONIX MX-300 / 検出器: CCD / 日付: 2012年11月8日 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射 | プロトコル: LAUE / 単色(M)・ラウエ(L): L / 散乱光タイプ: x-ray | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射波長 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 | 解像度: 1.6→50 Å / Num. obs: 259707 / % possible obs: 95 % / 冗長度: 2.3 % / Biso Wilson estimate: 2.81 Å2 / Rmerge(I) obs: 0.083 / Χ2: 1.006 / Net I/av σ(I): 8.331 / Net I/σ(I): 6.1 / Num. measured all: 579160 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 シェル | Diffraction-ID: 1 / 冗長度: 2.3 % / Rejects: _
|
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: 4EPL 解像度: 1.6→24.168 Å / SU ML: 0.14 / 交差検証法: FREE R-VALUE / σ(F): 1.39 / 位相誤差: 21.5 / 立体化学のターゲット値: ML
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.11 Å / 溶媒モデル: FLAT BULK SOLVENT MODEL | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 37.79 Å2 / Biso mean: 4.4795 Å2 / Biso min: 2 Å2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: final / 解像度: 1.6→24.168 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | Refine-ID: X-RAY DIFFRACTION / Total num. of bins used: 30
|
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj







