[English] 日本語
 Yorodumi
Yorodumi- PDB-5c11: Crystal Structure of Jarid1a PHD finger bound to histone H3C4me3 ... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 5c11 | ||||||
|---|---|---|---|---|---|---|---|
| Title | Crystal Structure of Jarid1a PHD finger bound to histone H3C4me3 peptide | ||||||
 Components Components |
| ||||||
 Keywords Keywords | HYDROLASE / zinc finger protein / demethylase / reader module | ||||||
| Function / homology |  Function and homology information Function and homology information[histone H3]-trimethyl-L-lysine4 demethylase / histone H3K4me/H3K4me2/H3K4me3 demethylase activity / facultative heterochromatin formation / : / histone demethylase activity / enzyme inhibitor activity / Chromatin modifying enzymes / telomere organization / Interleukin-7 signaling / RNA Polymerase I Promoter Opening ...[histone H3]-trimethyl-L-lysine4 demethylase / histone H3K4me/H3K4me2/H3K4me3 demethylase activity / facultative heterochromatin formation / : / histone demethylase activity / enzyme inhibitor activity / Chromatin modifying enzymes / telomere organization / Interleukin-7 signaling / RNA Polymerase I Promoter Opening / epigenetic regulation of gene expression / Assembly of the ORC complex at the origin of replication / Regulation of endogenous retroelements by the Human Silencing Hub (HUSH) complex / DNA methylation / Condensation of Prophase Chromosomes / Chromatin modifications during the maternal to zygotic transition (MZT) / SIRT1 negatively regulates rRNA expression / HCMV Late Events / ERCC6 (CSB) and EHMT2 (G9a) positively regulate rRNA expression / PRC2 methylates histones and DNA / Regulation of endogenous retroelements by KRAB-ZFP proteins / Defective pyroptosis / HDACs deacetylate histones / Regulation of endogenous retroelements by Piwi-interacting RNAs (piRNAs) / circadian regulation of gene expression / RNA Polymerase I Promoter Escape / Transcriptional regulation by small RNAs / Formation of the beta-catenin:TCF transactivating complex / protein-DNA complex / Activated PKN1 stimulates transcription of AR (androgen receptor) regulated genes KLK2 and KLK3 / RUNX1 regulates genes involved in megakaryocyte differentiation and platelet function / HDMs demethylate histones / NoRC negatively regulates rRNA expression / chromatin DNA binding / B-WICH complex positively regulates rRNA expression / PKMTs methylate histone lysines / Pre-NOTCH Transcription and Translation / Meiotic recombination / Activation of anterior HOX genes in hindbrain development during early embryogenesis / RMTs methylate histone arginines / Transcriptional regulation of granulopoiesis / HCMV Early Events / structural constituent of chromatin / nucleosome / nucleosome assembly / HATs acetylate histones / RUNX1 regulates transcription of genes involved in differentiation of HSCs / Factors involved in megakaryocyte development and platelet production / MLL4 and MLL3 complexes regulate expression of PPARG target genes in adipogenesis and hepatic steatosis / chromatin organization / Senescence-Associated Secretory Phenotype (SASP) / histone binding / Oxidative Stress Induced Senescence / gene expression / Estrogen-dependent gene expression / transcription coactivator activity / transcription cis-regulatory region binding / cadherin binding / chromatin remodeling / protein heterodimerization activity / Amyloid fiber formation / regulation of DNA-templated transcription / chromatin / positive regulation of DNA-templated transcription / nucleolus / negative regulation of transcription by RNA polymerase II / protein-containing complex / DNA binding / extracellular exosome / extracellular region / zinc ion binding / nucleoplasm / nucleus / membrane Similarity search - Function | ||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human)synthetic construct (others) | ||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / Resolution: 2.803 Å MOLECULAR REPLACEMENT / Resolution: 2.803 Å | ||||||
 Authors Authors | Huang, J. / Li, H. | ||||||
| Funding support |  China, 1items China, 1items
| ||||||
 Citation Citation |  Journal: Nat Commun / Year: 2015 Journal: Nat Commun / Year: 2015Title: Crystal Structure of Jarid1a PHD finger bound to histone H3C4me3 peptide Authors: Huang, J. / Li, H. | ||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  5c11.cif.gz 5c11.cif.gz | 27.2 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb5c11.ent.gz pdb5c11.ent.gz | 15.8 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  5c11.json.gz 5c11.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Summary document |  5c11_validation.pdf.gz 5c11_validation.pdf.gz | 433.3 KB | Display |  wwPDB validaton report wwPDB validaton report |
|---|---|---|---|---|
| Full document |  5c11_full_validation.pdf.gz 5c11_full_validation.pdf.gz | 433.4 KB | Display | |
| Data in XML |  5c11_validation.xml.gz 5c11_validation.xml.gz | 4.4 KB | Display | |
| Data in CIF |  5c11_validation.cif.gz 5c11_validation.cif.gz | 5 KB | Display | |
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/c1/5c11 https://data.pdbj.org/pub/pdb/validation_reports/c1/5c11 ftp://data.pdbj.org/pub/pdb/validation_reports/c1/5c11 ftp://data.pdbj.org/pub/pdb/validation_reports/c1/5c11 | HTTPS FTP |
-Related structure data
| Related structure data |  5c13C  3gl6S C: citing same article ( S: Starting model for refinement |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 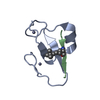
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| Unit cell |
|
- Components
Components
| #1: Protein | Mass: 5802.490 Da / Num. of mol.: 1 / Fragment: PHD finger domain, UNP residues 1609-1659 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: KDM5A, JARID1A, RBBP2, RBP2 / Plasmid: pET28b / Production host: Homo sapiens (human) / Gene: KDM5A, JARID1A, RBBP2, RBP2 / Plasmid: pET28b / Production host:  References: UniProt: P29375, Oxidoreductases; Acting on paired donors, with incorporation or reduction of molecular oxygen; With 2-oxoglutarate as one donor, and incorporation of one atom of oxygen into each donor | ||
|---|---|---|---|
| #2: Protein/peptide | Mass: 1190.416 Da / Num. of mol.: 1 / Source method: obtained synthetically Details: chemically synthesized H3 peptide 1-10 with K4Cme3 modification Source: (synth.) synthetic construct (others) / References: UniProt: P68431*PLUS | ||
| #3: Chemical | | Sequence details | THE SEQUENCE OF THE ENTITY2 OF THIS PROTEIN WAS NOT AVAILABLE AT THE UNIPROT KNOWLEDGEBASE DATABASE ...THE SEQUENCE OF THE ENTITY2 OF THIS PROTEIN WAS NOT AVAILABLE AT THE UNIPROT KNOWLEDGEB | |
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 3.67 Å3/Da / Density % sol: 66.47 % |
|---|---|
| Crystal grow | Temperature: 277 K / Method: vapor diffusion, sitting drop / pH: 8.5 Details: 0.02 M sodium l-glutamate, 0.02 M dl-alanine, 0.02 M glycine, 0.02 M dl-lysine HCl, 0.02 M dl-serine, 0.1 M Tris, 0.1 M Bicine, PH8.5, 12.5% MPD, 12.5% PEG 1K, 12.5% PEG 3350 |
-Data collection
| Diffraction | Mean temperature: 100 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  SSRF SSRF  / Beamline: BL17U / Wavelength: 0.9792 Å / Beamline: BL17U / Wavelength: 0.9792 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Detector | Type: ADSC QUANTUM 315r / Detector: CCD / Date: Sep 14, 2014 / Details: mirror | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radiation | Monochromator: double crystal, Si(111) / Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radiation wavelength | Wavelength: 0.9792 Å / Relative weight: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reflection | Resolution: 2.8→50 Å / Num. obs: 2920 / % possible obs: 99.5 % / Redundancy: 17.1 % / Biso Wilson estimate: 96.56 Å2 / Rmerge(I) obs: 0.065 / Χ2: 1.84 / Net I/av σ(I): 64.932 / Net I/σ(I): 14.3 / Num. measured all: 50009 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reflection shell | Diffraction-ID: 1 / Rejects: _
|
- Processing
Processing
| Software |
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: 3GL6 Resolution: 2.803→44.462 Å / SU ML: 0.35 / Cross valid method: FREE R-VALUE / σ(F): 1.47 / Phase error: 28.73 / Stereochemistry target values: ML
| ||||||||||||||||||||||||
| Solvent computation | Shrinkage radii: 0.9 Å / VDW probe radii: 1.11 Å / Solvent model: FLAT BULK SOLVENT MODEL | ||||||||||||||||||||||||
| Displacement parameters | Biso max: 146.66 Å2 / Biso mean: 95.2107 Å2 / Biso min: 56.37 Å2 | ||||||||||||||||||||||||
| Refinement step | Cycle: final / Resolution: 2.803→44.462 Å
| ||||||||||||||||||||||||
| Refine LS restraints |
| ||||||||||||||||||||||||
| LS refinement shell | Refine-ID: X-RAY DIFFRACTION / Total num. of bins used: 2
|
 Movie
Movie Controller
Controller











 PDBj
PDBj










